FIRMENFINANZIERTE FORSCHUNG - ERHEBLICHES MANIPULATIONSPOTENZIAL
"Wir haben dem IQWiG ausreichend Daten zur Verfügung gestellt, diejenigen Daten, die sich aus unserer Sicht für eine Nutzenbewertung von EDRONAX (Wirkstoff Reboxetin) auch im Vergleich zu anderen Mitteln eignen."1 So begründet die Firma Pfizer ihre Weigerung, dem IQWiG unveröffentlichte Studien mit dem Antidepressivum zu überlassen. Offensichtlich hält der derzeit größte Pharmahersteller der Welt nicht viel davon, alle durchgeführten Studien öffentlich zugänglich zu machen - was aus wissenschaftlicher Sicht eigentlich eine Selbstverständlichkeit wäre. Er will lieber eine Vorauswahl treffen. Hersteller haben üblicherweise Zugang zu allen Daten ihrer Produkte -, aber auch einen schwerwiegenden Interessenkonflikt. Der Grund, warum Pfizer zwei Drittel aller bislang in Studien erhobenen Daten zu Reboxetin unter Verschluss halten wollte und die Blockade erst nach öffentlichem Druck aufgab, ist klar: Die publizierten Studien suggerieren einen Nutzen von Reboxetin. Die Gesamtauswertung aller Daten lässt hingegen keinen Nutzen erkennen.2 Das ist leider kein Einzelfall.
Immer noch betrachten Firmen Studien, die sie finanziert haben, als Eigentum, das sie nach Belieben in ihren Tresoren verschwinden lassen können (a-t 2001; 32: 49). Die öffentliche Registrierung von Studien ist ein wichtiger Schritt gegen dieses selektive Publizieren. Der Beschluss von elf renommierten Medizinjournalen von 2004, nur noch Studien zu publizieren, die vor Aufnahme der Patienten öffentlich registriert wurden,3 hat den Druck auf Hersteller und Autoren, ihre Studien in Registern anzumelden, deutlich erhöht. In den USA müssen inzwischen alle klinischen Studien zu Arzneimitteln registriert und die Ergebnisse veröffentlicht werden. Die angelaufene Registrierung von Arzneimittelstudien in der europäischen Datenbank EudraCT erfüllt dagegen lediglich behördliche Bedürfnisse. Damit "die Vertraulichkeit der Daten gewahrt bleibt und die legitimen Interessen von Sponsoren geschützt werden"4, ist EudraCT bislang nur behördenintern zugänglich.4,5 Zudem ist "derzeit nicht vorgesehen", auch die Ergebnisse der Studien in die Datenbank aufzunehmen.4
Die Verpflichtung zur Registrierung und Veröffentlichung sämtlicher Studien dürfte den Kenntnisstand deutlich verbessern. Sie bleibt aber ohne relevanten Einfluss auf den Sponsorbias, die Einflussnahme von Pharmaherstellern auf Planung und Durchführung klinischer Studien, die sie finanzieren. Der Trend geht von der klassischen akademischen Forschung zu einem komplexen "Ghostmanagement"6: Im Extremfall werden Studien von der Pharmaindustrie konzipiert, von Auftragsforschungsinstituten ausgeführt und durch Ghostwriter(-Firmen) geschrieben (vgl. Seite 13, Oseltamivir). Prominente Akademiker lassen sich dafür bezahlen, dass sie ihren Namen als Autor hergeben, ohne nennenswerten Anteil an der Veröffentlichung zu haben. Schließlich wird die Arbeit über eine Kommunikationsagentur, die vielleicht sogar zu einem wissenschaftlichen Verlag gehört, in einer namhaften Zeitschrift untergebracht.7 Die Bearbeitung firmenfinanzierter Studien durch solche kommerziellen Einrichtungen scheint in jeder Beziehung für Firmen kalkulierbarer zu sein als solide akademische Forschung. Die Möglichkeiten verborgener Einflussnahme auf die Ergebnisse sind beträchtlich. Das Ausmaß der Beteiligung kommerzieller Strukturen sollte nicht unterschätzt werden: Die systematische Überprüfung von 44 firmenfinanzierten Studien, die von zwei dänischen Ethikkommissionen genehmigt worden sind, ergibt bei 33 Veröffentlichungen (75%) Hinweise auf Ghostwriter. Überwiegend handelt es sich dabei um Statistiker der finanzierenden Firmen.8
Können wir es uns wirklich leisten, Planung, Durchführung und Publikation von Studien den Firmen und den von ihnen finanziell abhängigen Auftragsinstituten und Ghostwritern zu überlassen? Ist eine medizinische Forschung akzeptabel, die zwar den formalen, auf statistische Signifikanz ausgelegten Zulassungskriterien genügt und auf die Vermarktung der Firmenprodukte ausgerichtet ist, aber therapeutisch wichtige Fragestellungen ausklammert, weil diese kommerziell uninteressant oder sogar unerwünscht sind? Praxisnahe Langzeitstudien wie etwa die CATIE-Studie zum Vergleich von atypischen Neuroleptika mit einem klassischen Phenothiazin werden typischerweise herstellerunabhängig finanziert, weil sie nicht Firmeninteressen entsprechen (a-t 2005; 36: 98-100). So werden auch die Vergleichsstudien zwischen dem extrem teuren vaskulären endothelialen Wachstumsfaktor Ranibizumab (LUCENTIS, Novartis) und dem preiswerteren, jedoch bei feuchter Makuladegeneration nicht zugelassenen Bevacizumab (AVASTIN, Roche) derzeit firmenunabhängig durchgeführt, weil die beiden finanziell über Aktienbeteiligungen verknüpften Anbieter Desinteresse signalisieren (a-t 2009; 40: 63-5). Kommerzielle Interessen behindern die Klärung therapeutisch und ökonomisch relevanter Fragestellungen.
Zahlreiche Untersuchungen belegen die Folgen des Sponsorings von Studien durch Pharmahersteller, das etwa 70%9 der Studien betreffen soll. Nach zwei 2003 erschienenen systematischen Übersichten von Übersichtsarbeiten, die insgesamt 1.140 bzw. 2.269 Studien einbeziehen, fallen herstellergestützte Studien etwa viermal so häufig zu Gunsten des Prüfpräparates aus wie Studien mit anderen Geldgebern (a-t 2003; 34: 62-3).10,11 Eine Nachfolgeübersicht, die 2.633 Studien der Jahre 2003 bis 2006 einbezieht, geht mit diesem Ergebnis konform.9
Die Auswertung aller herstellerfinanzierten randomisierten Studien mit nichtsteroidalen Antirheumatika (NSAR) bei rheumatoider Arthritis, die zwischen September 1987 und Mai 1990 veröffentlicht wurden, veranschaulicht das gute Abschneiden der Produkte der Sponsoren: 16-mal (29%) sind diese überlegen und 40-mal (71%) dem Vergleichspräparat gleichwertig. In keiner Studie wirkt das Produkt des Sponsors jedoch schlechter.12 Ähnlich auffällig sind Untersuchungen, in denen atypische Neuroleptika direkt miteinander verglichen werden: Bei paarweisen Vergleichen scheint jeweils die sponsernde Firma das bessere Mittel anzubieten. So fallen randomisierte kontrollierte Studien mit Olanzapin (ZYPREXA) versus Risperidon (RISPERDAL, Generika) zu Gunsten von Olanzapin aus, wenn Lilly der Sponsor ist (5 von 5 Studien) und zu Gunsten von Risperidon, wenn Janssen die Studie finanziert hat (3 von 4 Studien; "Neuroleptika-Paradoxon",
a-t 2006; 37: 92).13
Das Argument, dass Firmen Studien vor allem für solche Arzneimittel finanzieren, von deren besonderem Nutzen sie überzeugt sind und dies der Grund für die häufig positiven Ergebnisse für die Produkte des Geldgebers sei, läuft ins Leere, wenn die gegensätzlichen Ergebnisse direkter Vergleiche jeweils deutlich mit der Finanzierung assoziiert sind. Offensichtlich ist nicht das Arzneimittel ausschlaggebend, sondern das Design der Studien, also wie es getestet wird. Und hier gibt es genügend Stellrädchen, das Ergebnis einer Untersuchung in die gewünschte Richtung zu lenken (Designbias).
Eine inaktive Vergleichsgruppe beispielsweise (also Plazebo oder keine Therapie) lässt den Nutzen des Prüfproduktes automatisch günstiger erscheinen. Wird mit aktiver Therapie verglichen, sind - wenn überhaupt - weniger eindrucksvolle Unterschiede zu erwarten. Bei der Sichtung aller randomisierten Studien, die zwischen 1980 und 2002 zur Behandlung des multiplen Myeloms veröffentlicht wurden, verwundert es daher nicht, dass bei 60% der industriegesponserten Studien (n = 35) inaktive Vergleichsgruppen gewählt werden, aber nur bei 21% der öffentlich finanzierten Studien (n = 95).14
Auch die Wahl der Dosis beeinflusst das Ergebnis wesentlich. Wird das Prüfprodukt in höherer Äquivalenzdosis getestet als das Vergleichspräparat, schneidet es in puncto Wirksamkeit tendenziell besser ab. Auch diese Strategie wird systematisch verfolgt: In 27 (54%) von 50 herstellergesponserten randomisierten kontrollierten Studien der Jahre 1987 bis 1990 mit NSAR bei rheumatoider Arthritis ist die Dosis des Prüfproduktes höher als die der Kontrolle, in 21 Studien (42%) in etwa äquivalent und lediglich in 2 Studien (4%) niedriger.12
Direkte Manipulationen von Studiendaten kommen nur gelegentlich an die Öffentlichkeit, am ehesten in Verbindung mit Gerichtsverfahren in den USA. So beleuchten Gerichtsgutachten strategische Verfälschungen von Studiendaten zum Off-label-Gebrauch des Antiepileptikums Gabapentin (NEURONTIN, Generika), den die Firma Pfizer propagiert hatte. Durch Veränderung des primären Endpunktes bei fünf Studien sowie Nichtveröffentlichung ungünstiger Daten wird eine Wirksamkeit von Gabapentin bei Off-label-Indikationen wie Migräneprophylaxe vorgetäuscht
(a-t 2009; 40: 109).15
Den besten Überblick über die Diskrepanz zwischen den durchgeführten Studien und dem tatsächlich veröffentlichten Kenntnisstand sollten - neben den Firmen selbst - die Zulassungsbehörden haben. Aber auch bei den meisten Behörden verschwinden unveröffentlichte Studien in der Versenkung. In Deutschland und Europa berufen sie sich auf das "Betriebsgeheimnis" der Hersteller und verweigern auch für wissenschaftliche Fragestellungen eine Weitergabe nicht veröffentlichter Studiendaten.
In nur wenigen zugänglichen Arbeiten sind Zulassungsunterlagen systematisch mit den entsprechenden Veröffentlichungen abgeglichen worden. 2003 erscheint eine Auswertung der 42 herstellergesponserten Studien zu fünf selektiven Serotonin-Wiederaufnahmehemmern (SSRI), die der schwedischen Behörde im Rahmen von Zulassungsanträgen vorgelegt wurden. Die Arbeit mit der bezeichnenden Überschrift "Evidence b(i)ased medicine" dokumentiert das Prinzip des selektiven Veröffentlichens (Publikationsbias):16 Einerseits erscheinen Positivstudien mit signifikantem Unterschied des SSRI zu Plazebo dreimal so häufig als Einzelveröffentlichung - zum Teil gleich doppelt - wie Studien mit nicht signifikantem Ergebnis. Andererseits sind vier der insgesamt 21 Negativstudien gar nicht publiziert und elf lediglich in Sammelveröffentlichungen. Obwohl alle Arbeiten bei der Behörde mit Intention-to-treat-Analyse eingereicht werden mussten, fehlt bei drei Viertel der veröffentlichten Einzelstudien die Darstellung der Ergebnisse nach dieser im Vergleich zur Per-Protokoll-Analyse aussagekräftigeren Auswertung, die aber für das Prüfprodukt meist ungünstiger ausfällt. Die Autoren folgern, dass "jegliche Empfehlung eines SSRI auf der Basis der veröffentlichten Daten ... auf einer verzerrten Datenlage" beruht (a-t 2003; 34: 62-3).16
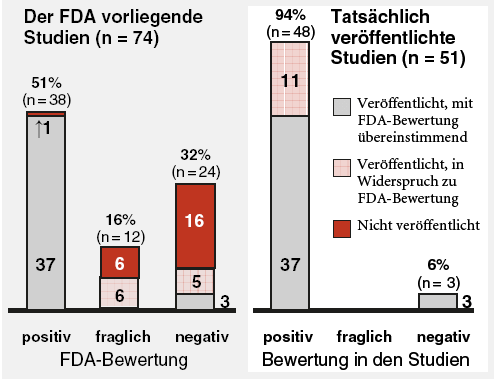
Dies bestätigt sehr deutlich eine 2008 erschienene Auswertung der 74 von 1987 bis 2004 bei der amerikanischen Arzneimittelbehörde FDA eingereichten Studien zu zwölf Antidepressiva
(a-t 2008; 39: 22).17 Die Gesamtheit der bei der Behörde vorliegenden Studien spiegelt die widersprüchliche Datenlage für Antidepressiva wider (51% der Studien mit positivem Ergebnis, 49% negativ oder nicht eindeutig, n = 74; siehe linkes Schaubild). Bei Sichtung der veröffentlichten Antidepressivastudien scheint die Datenlage hingegen eindeutig positiv zu sein (94% positiv, 6% negativ, n = 51; s. Abb., rechtes Schaubild).
Das Ausmaß unveröffentlicht gebliebener Studien ist erschreckend. Nach systematischen Auswertungen scheinen sogar 50% und mehr der abgeschlossenen Studien unterdrückt zu werden.18,19
Abbildung: Ausmaß und Folgen von Publikationsbias und Datenmanipulationen am Beispiel der 74 Studien zu 12 Antidepressiva, die der amerikanischen Zulassungsbehörde FDA zwischen 1984 und 2004 eingereicht wurden. Von insgesamt 38 für die Prüfpräparate positiven Studien ist nur eine nicht veröffentlicht. 36 Studien sind nach Bewertung der FDA negativ (n = 24) oder nicht eindeutig (n = 12) ausgefallen (siehe linkes Schaubild).17 Von diesen sind aber nur 3 veröffentlicht, 22 nicht. 11 wurden vor Veröffentlichung so manipuliert, dass ein positives Ergebnis vorgetäuscht wird. Die Gesamtschau der veröffentlichten Daten scheint auf diese Weise eindeutig positiv auszufallen (rechtes Schaubild). Per Datenbankrecherche finden sich lediglich 51 der Studien. Davon sind 48 (94%) für das Prüfpräparat positiv (37 tatsächlich positiv, 11 geschönt, was den Veröffentlichungen nicht anzumerken ist) und lediglich 3 negativ.siehe Abb., rechtes Schaubild).
Defizite bestehen auch bei Erfassung und Dokumentation unerwünschter Wirkungen (UAW) in Studien. Bei der systematischen Überprüfung von 133 randomisierten kontrollierten Studien, die 2006 in fünf großen Medizinjournalen veröffentlicht wurden, fehlen bei 11% der Studien Angaben zu UAW. 27% geben keine Informationen über die Schwere der UAW, und bei 32% der Studien werden UAW lediglich eingeschränkt dargestellt: nur häufige, nur schwere bzw. nur statistisch signifikante UAW.20 In der Auswertung wird nicht zwischen firmen- und öffentlich gesponserten Studien unterschieden. Verharmlosung und Desinformation sind für uns allerdings allgegenwärtig, wenn wir bei Herstellern nach unerwünschten Wirkungen ihrer Produkte fragen (vgl. a-t 2002; 33: 123-4). Anlässlich der Marktrücknahme von Rofecoxib (VIOXX) am 22. Oktober 2004 (a-t 2004; 35: 125-8) schaltet MSD in großen Tageszeitungen ganzseitige Anzeigen: "MSD hat Behörden, Ärzte und Apotheker im Interesse des Patientenwohls stets umgehend informiert. ... Wir leben Verantwortung."21 Eine Woche später belegt das Wall Street Journal das Gegenteil. Es zitiert interne E-Mails, aus denen hervorgeht, dass die Firma seit Mitte der 1990er Jahre Hinweise auf Kardiotoxizität des Cox-2-Hemmers hatte.22 Merck & Co. (MSD) diskutierte intern bereits damals, wie Studien angelegt sein müssen, damit das kardiovaskuläre Schädigungspotenzial von Rofecoxib nicht auffällt (a-t 2004; 35: 117-8). Durch Vertuschungsstrategie ist beispielsweise auch SmithKline Beecham (heute GlaxoSmithKline) aufgefallen. Die Firma wies Mitarbeiter in einer internen Mitteilung an, Ergebnisse klinischer Studien, die Wirkungslosigkeit von Paroxetin (SEROXAT, Generika) bei depressiven Jugendlichen erkennen lassen, nicht publik zu machen. Diese seien "kommerziell unakzeptabel" (a-t 2004; 35: 29-30).
Manipulation und Unterdrückung von firmenfinanzierten Daten zu erwünschten und unerwünschten Wirkungen von Arzneimitteln haben ein erschreckendes Ausmaß und erschweren eine realistische Abwägung von Nutzen und Schaden auf der Basis der veröffentlichten Daten. Dies wirkt sich auf Metaanalysen und Leitlinien aus, die überwiegend auf der Grundlage veröffentlichter Studien erarbeitet werden. Ärzte verordnen nichts ahnend Arzneimittel, deren Nutzen nur vorgetäuscht und deren Verträglichkeit unzureichend gesichert ist. Therapiefehler sind die Folge - zum Schaden von Patienten und Gesundheitssystem. Geld wird für nutzlose oder riskante Produkte verschwendet.
Und nicht zuletzt ist Datenunterdrückung Betrug an den Studienteilnehmern, die sich für eine Studie zur Verfügung gestellt und damit auch ein persönliches Risiko auf sich genommen haben, um den medizinischen Erkenntnisfortschritt zu fördern. Dies stellt die Rechtmäßigkeit der Einwilligungen zur Teilnahme an den Studien infrage.
Klinische Studien sind eine Grundvoraussetzung für eine verlässliche Beurteilung von Nutzen und Schaden von Arzneimitteln, Medizinprodukten und anderen Therapeutika und therapeutischen Methoden. Aus wissenschaftlicher und ethischer Sicht muss der öffentliche Zugang zu solchen Daten selbstverständlich sein und garantiert werden.
Sponsoring von Studien durch die Hersteller der Prüfprodukte begünstigt Unterdrückung und Manipulation unliebsamer Studienergebnisse.
Die verpflichtende Registrierung vor Studienbeginn in zentralen Studienregistern ist ein wichtiger Schritt, schützt jedoch nicht vor den vielfältigen Möglichkeiten der Einflussnahme der Geldgeber auf die Ergebnisse der Untersuchungen. Der darauf beruhende Bias lässt sich nicht durch methodische oder statistische Verfahren korrigieren.
Manipulierte Studien sind weder eine Ausnahmeerscheinung noch handelt es sich um ein Kavaliersdelikt. Abhilfe ist ebenso einfach wie unter den derzeitigen Rahmenbedingungen unrealistisch. Nur eine vollständige Trennung von Forschungsfinanzierung und Firmengeldern kann Sponsoringbias und die darauf beruhende Verfälschung wissenschaftlicher Daten eliminieren.7
Die verantwortlichen Firmenmanager und wissenschaftlichen Autoren sollten für Verfälschung und Unterdrückung von Daten sowie illegales Marketing persönlich und strafrechtlich haften, wobei auch Haftstrafen nicht auszuschließen sind. Denn selbst Strafzahlungen von Firmen in Höhe von Milliarden Dollar scheinen unethische Vermarktungsstrategien nicht stoppen zu können.
Erratum a-t 2010; 41: 24
| 1 | Pfizer: "Pfizer weist IQWiG-Vorwürfe zurück", Pressemitteilung vom 10. Juni 2009 | |
| 2 | IQWiG: "Antidepressiva: Nutzen von Reboxetin ist nicht belegt", Pressemitteilung vom 24. Nov. 2009; http://www.iqwig.de/index.867.html | |
| 3 | DeANGELIS, C.D. et al.: JAMA 2004; 292: 1363-4 | |
| 4 | Bundesministerium für Gesundheit, Antwort Kleine Anfrage betreffend "Verpflichtendes Register zur Veröffentlichung von klinischen Studien", BT-Drs 17/163 | |
| 5 | BAHR, D., zit. Nach aerzteblatt.de: "BAHR: Nicht alle klinischen Studien sollen veröffentlicht werden", vom 6. Jan. 2010 | |
| 6 | SISMONDO, S.: PLoS Medicine 2007; 4: e286 (5 Seiten) | |
| 7 | DOUCET, M., SISMONDO, S.: J. Med. Ethics 2008; 34: 627-30 | |
| 8 | GØTZSCHE, P.C. et al.: PLoS Medicine 2007; 4: e19 (6 Seiten) | |
| 9 | SISMONDO, S.: Contemp. Clin. Trials 2008; 29: 109-13 | |
| 10 | BEKELMAN, J.E. et al.: JAMA 2003; 289: 454-65 | |
| 11 | LEXCHIN, J. et al.: Brit. Med. J. 2003; 326: 1167-76 | |
| 12 | ROCHON, P.A. et al.: Arch. Intern. Med. 1994; 154: 157-63 | |
| 13 | HERES, S. et al.: Am. J. Psychiatry 2006; 163: 185-94 | |
| 14 | DJULBEGOVIC, B. et al.: Lancet 2000; 356: 635-8 | |
| 15 | VEDULA, S.S. et al.: N. Engl. J. Med. 2009; 361: 1963-71 | |
| 16 | MELANDER, H. et al.: BMJ 2003; 326: 1171-5 | |
| 17 | TURNER, E.H. et al.: N. Engl. J. Med. 2008; 358: 252-60 | |
| 18 | DECULLIER, E. et al.: BMJ 2005; 331: 19 (6 Seiten) | |
| 19 | ANTES, G. et al.: Bundesgesundheitsbl. 2009; 52: 459-62 | |
| 20 | PITROU, I. et al.: Arch. Intern. Med. 2009; 169: 1756-61 | |
| 21 | z.B. Süddtsch. Ztg. vom 22. Okt. 2004 | |
| 22 | Wall Street Journal, 1. Nov. 2004 |
© 2010 arznei-telegramm, publiziert am 15. Januar 2010
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
