UMECLIDINIUM-VILANTEROL-INHALAT (ANORO) BEI COPD
Mit Umeclidiniumbromid-Vilanterol-Inhalat (ANORO) ist seit Juli 2014 neben Glykopyrroniumbromid-Indacaterol-Inhalat (ULTIBRO BREEZHALER; siehe Kasten) die zweite Fixkombination eines langwirkenden Anticholinergikums mit einem langwirkenden Beta2-Mimetikum zur symptomatischen Dauertherapie der chronisch obstruktiven Lungenerkrankung (COPD)1 im Handel. Derartige Kombinationen werden – abhängig von der Stärke der Beschwerden – in der Leitlinie der Global Initiative for Chronic Obstructive Lung Disease (GOLD) bei stabiler COPD empfohlen, jedoch nur als Alternative zu einem langwirkenden Bronchodilatator allein als erster Wahl, gegebenenfalls in Kombination mit einem inhalativem Glukokortikoid (siehe auch Seite 97).2
Die Neuerung wird in drei randomisierten Studien3,4 mit Tiotropium (SPIRIVA) als Standardtherapie verglichen, wobei gleichzeitige Anwendung inhalativer Glukortikoide erlaubt ist.3-5 Insgesamt 1.757* im Mittel 63 Jahre alte Patienten mit wenigstens mittelschwerer COPD (Einsekundenkapazität [FEV1] postbronchodilatatorisch < 80% des Sollwerts) inhalieren entweder die neue Fixkombination in der zugelassenen Dosierung von einmal täglich 55 µg/22 µg oder einmal täglich 18 µg Tiotropium. Primärer Endpunkt ist der FEV1-Talwert** nach 24-wöchiger Therapie. Eine üblicherweise als klinisch relevant geltende Verbesserung von im Mittel wenigstens 100 ml wird gegenüber Tiotropium nur in einer der Studien erreicht, die bislang noch nicht publiziert ist (um 112 ml bzw. in den anderen um 90 ml und 60 ml).5 Auch die krankheitsspezifische Lebensqualität, gemessen mittels des validierten St. George’s Respiratory Questionnaire,*** wird nur in der nicht veröffentlichten Studie signifikant, im Mittel jedoch nicht klinisch relevant gegenüber Tiotropium verbessert (–2,1 Punkte auf einer 100 Punkte umfassenden Skala, in den anderen Studien um –0,17 Punkte bzw. Verschlechterung um 0,75 Punkte).5 Möglicherweise sind die Ergebnisse durch eine unsichere Verblindung3 verzerrt. Anders als für Tiotropium (a-t 2007; 38: 37-9, 2008; 39: 111 und 2011; 42: 35-6) ist für die Kombination eine Senkung der Exazerbationsrate im Vergleich zu Plazebo6 nicht gesichert. Gegenüber Tiotropium reduziert die Fixkombination das Risiko in einer der Studien um 50% und steigert es in den anderen beiden um 20% und 90%, wobei keine der Studien darauf angelegt war, die Wirkung auf Exazerbationen zu untersuchen.1,5 Vorteile hinsichtlich der Verträglichkeit sind nicht belegt. Unter der Fixkombination sind in allen drei Studien im Vergleich zu Tiotropium Kopfschmerzen (9% bis 10% versus 4% bis 7%) sowie Therapieabbrüche wegen Störwirkungen (4% bis 9% vs. 2% bis 5%) numerisch häufiger.3-5 Die Langzeitsicherheit, insbesondere hinsichtlich kardio- und zerebrovaskulärer Störwirkungen, soll in einer Beobachtungsstudie nach Markteinführung untersucht werden.5
| * | Zwei der Studien3 randomisieren in weiteren Therapiearmen zu Umeclidinium in einer höheren Dosierung von 113 µg bzw. Vilanterol 22 µg allein sowie zur Kombination aus beiden. Insgesamt werden 2.427 Patienten randomisiert |
| ** | Er wird hier als Mittel der 23 und 24 Stunden nach letzter Anwendung gemessenen Werte bestimmt. |
| *** | St. George’s Respiratory Questionnaire: Krankheitsspezifischer, vom Patienten auszufüllender Fragebogen zu Beschwerden, Aktivität und Beeinträchtigungen. Als klinisch relevant gilt ein Unterschied von wenigstens 4 Punkten.7 Metaanalysen errechnen gegenüber Plazebo für Tiotropium im Mittel eine Verbesserung um 2,89 Punkte und für Formoterol um 2,66 Punkte.8,9 |
Zusatznutzen von Glykopyrronium-Indacaterol-Inhalat (ULTIBRO BREEZHALER)?
Im Mai 2014 sah der Gemeinsame Bundesausschuss (G-BA) einen Hinweis bzw. einen Anhaltspunkt für einen geringen Zusatznutzen der seit November 2013 angebotenen inhalativen Fixkombination ULTIBRO BREEZHALER aus Glykopyrronium (SEEBRI BREEZHALER; e a-t 01/2013a) und Indacaterol (ONBREZ BREEZHALER; a-t 2010; 41: 4) gegenüber der Inhalation von Tiotropium (SPIRIVA) plus Formoterol (FORADIL, Generika) bei schwerer COPD und höchstens einer Exazerbation pro Jahr sowie bei mäßiggradiger COPD. Grundlage hierfür ist die bislang nicht publizierte doppelblinde randomisierte QUANTIFY-Studie mit 934 Patienten.1 In der primär untersuchten, mit dem St. George’s Respiratory Questionnaire* ermittelten krankheitsbezogenen Lebensqualität findet sich allerdings kein Vorteil für die Fixkombination.2
Die positive Bewertung des G-BA beruht auf nicht im Prüfplan vorgesehenen Subgruppenanalysen zur Atemnot bzw. zu COPD-Beschwerden, die mit dem Transition Dyspnea Index (TDI) bzw. dem COPD-Assessment-Test gemessen werden.1,2 Angesichts dessen, dass sich auch für diese Endpunkte in den ursprünglich geplanten Analysen keine signifikanten Unterschiede finden,2 erscheinen uns diese Auswertungen für die Annahme eines Zusatznutzens nicht geeignet. Den in COPD-Studien häufig untersuchten TDI hält die US-amerikanische Arzneimittelbehörde (FDA) zudem für nicht ausreichend validiert.3,4
Kardiale Störwirkungen sind in der QUANTIFY-Studie unter Glykopyrronium-Indacaterol-Inhalat numerisch häufiger als unter Tiotropium plus Formoterol (3,2% versus 1,3%, schwerwiegend: 1,7% vs. 0,9%).2 Zur Beurteilung kardiovaskulärer und anderer Risiken im Vergleich mit zugelassenen Therapien muss der Hersteller als Zulassungsauflage eine Sicherheitsstudie durchführen.5
Ein Zusatznutzen von Glykopyrronium-Indacaterol-Inhalat (ULTIBRO BREEZHALER) gegenüber der Inhalation von Tiotropium (SPIRIVA) plus Formoterol (FORADIL, Generika) bei COPD erscheint uns nicht hinreichend belegt.
| 1 | G-BA: Tragende Gründe zu Indacaterol/Glycopyrronium, 8. Mai 2014 http://www.a-turl.de/?k=aube |
| 2 | Novartis: Dossier zur Nutzenbewertung gemäß § 35a SGB V, Modul 4A, Stand 4. Nov. 2013; http://www.a-turl.de/?k=itzs |
| 3 | FDA: Medical Review(s) Aclidinium bromide, Stand Mai 2012 http://www.a-turl.de/?k=asta |
| 4 | FDA: Medical Review(s) Tiotropium, Stand Dez. 2002 zu finden unter: http://www.a-turl.de/?k=yste |
| 5 | EMA: Europ. Beurteilungsbericht (EPAR) ULTIBRO BREEZHALER, Stand Juli 2013; http://www.a-turl.de/?k=atsh |
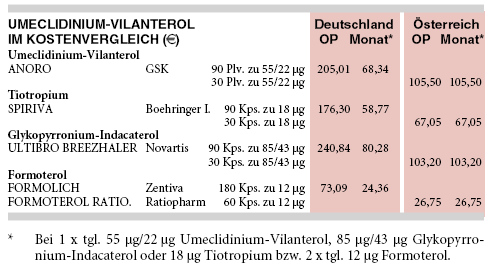
Einmal täglich Umeclidinium-Vilanterol-Inhalat (ANORO) kostet 68 € pro Monat und damit 16% mehr als einmal täglich Tiotropium-Inhalat (SPIRIVA: 59 €), 18% weniger als die Kombination von Tiotropium mit einem günstigen Formoterol-Generikum (zweimal täglich 12 µg mit FORMOLICH: 24 €) und 15% weniger als die Glykopyrronium-Indacaterol-Kombination ULTIBRO BREEZHALER (80 €).
Mit Umeclidinium-Vilanterol-Inhalat (ANORO) ist die zweite Fixkombination aus langwirkendem Anticholinergikum und langwirkendem Beta2-Mimetikum zur Behandlung der chronisch obstruktiven Lungenerkrankung (COPD) im Handel.
Klinisch relevante Vorteile hinsichtlich Besserung der Lungenfunktion und der Lebensqualität gegenüber inhaliertem Tiotropium (SPIRIVA) erscheinen uns nicht hinreichend belegt. Eine Senkung der Exazerbationsrate ist anders als für Tiotropium nicht gesichert.
Beim derzeitigen Kenntnisstand sehen wir keinen Stellenwert für die neue Kombination.
| (R = randomisierte Studie, M = Metaanalyse) | |
| 1 | GlaxoSmithKline: Fachinformation ANORO, Stand Mai 2014 |
| 2 | GOLD: Global Strategy for Diagnosis, Management, and Prevention of COPD, Stand Jan. 2014; http://www.a-turl.de/?k=ukru |
| R 3 | DECRAMER, M. et al.: Lancet Respir. Med. 2014; 2: 472-86 |
| R 4 | GlaxoSmithKline: Zusammenfassung zur Studie ZEP117115 http://www.a-turl.de/?k=uchl |
| 5 | EMA: Europ. Beurteilungsbericht (EPAR) ANORO, Stand März 2014 http://www.a-turl.de/?k=iden |
| R 6 | DONOHUE, J.F. et al.: Respir. Med. 2013; 107: 1538-46 |
| 7 | JONES, P.W.: COPD 2005; 2: 75-9 |
| M 8 | KARNER, C. et al.: Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews, Stand Febr. 2012; Zugriff Okt. 2014 |
| M 9 | KEW, K.M. et al.: Long-acting beta2-agonists for chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews, Stand Juni 2013; Zugriff Okt. 2014 |
© 2014 arznei-telegramm, publiziert am 17. Oktober 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
