BIOLOGIKA IN DER THERAPIE DER RHEUMATOIDEN ARTHRITIS
Die Behandlung der rheumatoiden Arthritis hat sich in den letzten 15 Jahren stark verändert (vgl. a-t 1997; Nr. 3: 29-32).1 Als Therapieziel wird heute die Remission oder zumindest - insbesondere bei länger bestehender Erkrankung - eine geringe Krankheitsaktivität empfohlen, um auf diese Weise einer progressiven Gelenkzerstörung vorzubeugen. Eine intensive Therapie mit Basistherapeutika (DMARDs*) soll so früh wie möglich nach Diagnosestellung beginnen. Der Erfolg soll zudem mithilfe validierter Skalen (zum Beispiel DAS28**) engmaschig kontrolliert und die Therapie bei unzureichendem Ansprechen unverzüglich angepasst werden.1-4
| * | DMARD = Disease Modifying Antirheumatic Drug; Arzneimittel mit krankheitsmodifizierenden Eigenschaften |
| ** | DAS = Disease Activity Score; erfasst die Zahl geschwollener sowie druckschmerzhafter Gelenke, das gesundheitliche Befinden der Patienten nach Selbsteinschätzung auf einer visuellen Analog-Skala sowie als Entzündungsparameter entweder das C-reaktive Protein oder die Blutsenkungsgeschwindigkeit; Kalkulatoren auch im Internet verfügbar ( www.das-score.nl); meist wird der DAS28 (= 28 Gelenke zu überprüfen) verwendet: < 2,6 Punkte = Remission, < 3,2 geringe, ≥ 3,2 bis ≤ 5,1 mäßige, > 5,1 hohe Krankheitsaktivität. |
Die vor gut zehn Jahren erstmals in Deutschland eingeführten Tumornekrosefaktor (TNF)-alfa-Hemmstoffe wie Infliximab (REMICADE) oder Etanercept (ENBREL; a-t 2000; 31: 26-7) und andere Biologika wie Rituximab (MABTHERA) haben zu den Veränderungen in der Therapie der rheumatoiden Arthritis beigetragen. Sie haben heute einen allgemein anerkannten Stellenwert als Reservemittel. Insgesamt sind fünf TNF-alfa-Hemmstoffe zur Behandlung der rheumatoiden Arthritis zugelassen, neben Infliximab und Etanercept Adalimumab (HUMIRA; a-t 2003; 34: 91-2), Certolizumab (CIMZIA) und Golimumab (SIMPONI). Sie unterscheiden sich in Dosis, Applikationsart und -intervall sowie in der exakten Formulierung des Anwendungsgebietes. Darüber hinaus werden vier weitere anders wirkende Biologika gegen die rheumatoide Arthritis angeboten: der Interleukin-1-Rezeptorantagonist Anakinra (KINERET; a-t 2002; 33: 49-50), der T-Zell-Costimulator-Modulator Abatacept (ORENCIA), der Anti-CD20-Antikörper Rituximab und der Interleukin-6-Rezeptorantagonist Tocilizumab (ROACTEMRA; siehe Tabelle).
ERSTTHERAPIE - ERSTWAHLMITTEL METHOTREXAT: Der Folsäureantagonist Methotrexat (MTX; LANTAREL, Generika) ist nach wie vor das besterprobte Basisantirheumatikum. Einmal wöchentlich (7,5 mg bis 20 mg5) angewendet, lindert Methotrexat im Vergleich zu Plazebo Schmerzen, mindert die Zahl betroffener Gelenke, führt zu funktioneller Verbesserung und verzögert das Fortschreiten von radiologisch gemessenen Gelenkschädigungen.6,7
Ein Vorteil anderer "klassischer" DMARDs wie Sulfasalazin (AZULFIDINE, Generika) gegenüber Methotrexat ist nicht belegt. Sulfasalazin, Leflunomid (ARAVA, Generika;
vgl. a-t 2010; 41: 115-6) und intramuskuläres Gold (TAUREDON) scheinen beim derzeitigen Kenntnisstand Methotrexat nicht unterlegen zu sein.2 Sie sind aber weniger erprobt und werden schlechter vertragen.8,9 Diese DMARDs werden als Reservemittel in der Ersttherapie empfohlen, wenn Methotrexat nicht vertragen wird oder kontraindiziert ist.2 Malariamittel wie Hydroxychloroquin (QUENSYL) schützen dagegen weniger vor Gelenkdestruktionen als andere DMARDs.2 Für die Monotherapie mit TNF-alfa-Hemmern ist in diesen Situationen ebenfalls kein hinreichender Vorteil gegenüber Methotrexat nachgewiesen.10
Im Rahmen der Ersttherapie einer aktiven rheumatoiden Arthritis soll daher, wenn immer möglich, Methotrexat verwendet werden, und zwar - abgesehen von zusätzlichen Glukokortikoiden - möglichst als Monotherapie.2 Die Kombination mit anderen klassischen DMARDs hat bei unvorbehandelten Patienten keine Vorteile gegenüber Methotrexat allein.11 Eine Ausnahme scheinen Glukokortikoide zu sein, für die inzwischen ebenfalls krankheitsmodifizierende Eigenschaften nachgewiesen sind.12 Wegen der um Wochen bis Monate verzögert einsetzenden Wirksamkeit von DMARDs werden Kortikoide heute unter anderem als "Brückentherapie" bei Behandlungsbeginn empfohlen.2-4 Die Kombination von DMARDs mit Glukokortikoiden in der Frühtherapie wirkt sich in mehreren zweijährigen Studien besser auf radiologisch erfasste Gelenkschäden und Symptomatik aus als der Beginn mit einem DMARD allein.13-15 Insbesondere wegen langfristiger unerwünschter Effekte wie Osteoporose sollen Glukokortikoide nach bisherigen Empfehlungen aber möglichst nur kurzfristig verwendet werden.2,4 Optimale Dosis und Dauer sind unzureichend geklärt.4,12
Die Kombination von Methotrexat mit einem Biologikum schneidet in der Erstbehandlung in reinen Wirkstoffvergleichen im Hinblick auf Symptome und Fortschreiten von Gelenkschäden zwar besser ab als Methotrexat allein.10 Hinweise aus Studien zu unterschiedlichen Strategien einer Frühtherapie (GUEPARD***- und TEAR***- Studie16,17) sprechen aber derzeit dafür, dass der Beginn mit der Kombination dem Beginn mit MTX-Monotherapie nicht überlegen ist, wenn in der Kontrollgruppe unter engmaschiger Erfassung der Krankheitsaktivität bei unzureichendem Ansprechen auf die Monotherapie ein Biologikum ergänzt wird. Die GUEPARD-Studie ist mit 65 Patienten allerdings sehr klein16 und die vierarmige TEAR-Studie ist selbst mit 755 Patienten noch unzureichend gepowert:17 Hier wird im faktoriellen Design in zwei Armen die primäre MTX-Kombination mit Etanercept oder mit Sulfasalazin plus Hydroxychloroquin, in zwei weiteren Armen die primäre MTX-Monotherapie mit Ergänzung des Biologikums oder der klassischen DMARDs bei unzureichendem Ansprechen geprüft. Die Frage bedarf weiterer klärender Studien. Die Ergebnisse besonders der TEAR-Studie stützen aber aktuelle Leitlinien-Empfehlungen, nach denen Biologika in der Regel nicht zur Ersttherapie verwendet werden sollen.2,4
| *** | GUEPARD = GUérir la PolyArthrite Rhumatoïde Débutante TEAR = Treatment of Early Aggressive Rheumatoid Arthritis |
BIOLOGIKA - OPTION NACH VERSAGEN DER ERSTTHERAPIE: Alle neun bei rheumatoider Arthritis zugelassenen Biologika sind in Kombination mit Methotrexat bei unzureichendem Ansprechen auf MTX geprüft. Die Kombination dämpft die Krankheitsaktivität stärker als die fortgesetzte Monotherapie mit MTX und verzögert das radiologisch gemessene Fortschreiten von Gelenkschäden.10 Auch die Kombination von MTX mit einem konventionellen Basisantirheumatikum wirkt nach einer Metaanalyse, in der fünf überwiegend kleine Studien erfasst werden, in diesen Situationen besser auf die Krankheitsaktivität als Fortsetzung mit MTX allein. Gemessen an der Rate der Therapieabbrecher wegen Wirkungslosigkeit oder unerwünschter Effekte als Indikator für die Balance von Nutzen und Schaden bieten zusätzliche klassische DMARDs in diesen Studien jedoch keinen Vorteil.18
In der SWEFOT****-Studie wird der Zusatz eines Biologikums nach Versagen der MTX-Therapie erstmals nicht mit Plazebo, sondern mit dem Zusatz klassischer DMARDs verglichen. An der offen durchgeführten Studie nehmen 258 Patienten mit früher rheumatoider Arthritis und hoher Krankheitsaktivität (DAS28 im Mittel 5,9) teil, bei denen der DAS28 nach drei- bis viermonatiger MTX-Therapie weiterhin über 3,2 liegt. Sie werden randomisiert einer Kombination von MTX mit Infliximab oder mit Sulfasalazin plus Hydroxychloroquin zugeteilt. Das Biologikum ist den klassischen DMARDs im Hinblick auf das "gute Ansprechen nach EULAR*****-Kriterien" (Senkung des DAS28 um mindestens 1,2 und auf unter 3,2) nach einem Jahr signifikant überlegen (primärer Endpunkt; 39% vs. 25%), nach zwei Jahren immer noch numerisch (38% vs. 31%). Die Rate der Therapieabbrecher insgesamt und wegen Wirkungslosigkeit ist in der Gruppe mit den klassischen DMARDs zudem höher (43% vs. 30% bzw. 18% vs. 4%). Radiologisch gemessene Gelenkschäden nehmen unter dem Biologikum signifikant weniger zu. Die klinische Relevanz der Differenz ist aber unklar.19,20
| **** | SWEFOT = Swedish Farmacotherapy |
| ***** | EULAR = The European League Against Rheumatism |
Die doppelblinde TEAR-Studie (siehe oben) findet keinen Unterschied im Hinblick auf die Krankheitsaktivität im zweiten Studienjahr (primärer Endpunkt) zwischen der Gruppe mit zusätzlichem Etanercept im Fall von MTX-Versagen und der mit zusätzlichem Sulfasalazin plus Hydroxychloroquin.17 Eine Gleichwertigkeit der Regime kann die Studie aus methodischen Gründen - unzureichende Power, kein randomisierter Vergleich der Step-up-Therapie - aber nicht belegen.
Gemäß der EULAR-Leitlinie von 2010 soll sich das weitere Vorgehen bei Patienten, die auf MTX unzureichend ansprechen, nach der Schwere des Krankheitsbildes richten: Liegen Marker für eine ungünstige Prognose vor - Nachweis von Rheumafaktor und/oder Antikörpern gegen citrullinierte Peptide, hohe Krankheitsaktivität oder frühes Auftreten von Erosionen - soll ein Biologikum ergänzt werden. Fehlen diese Marker, kann vorher noch ein drei- bis sechsmonatiger Versuch mit Umstellung auf ein anderes klassisches DMARD unternommen werden. Randomisierte kontrollierte Studien, die dieses an der Prognose orientierte Vorgehen prüfen, gibt es jedoch nicht.2 Ähnliches rät die neue S1-Leitlinie der Deutschen Gesellschaft für Rheumatologie (DGRh), die allerdings bei fehlenden ungünstigen Prognosefaktoren nicht den Wechsel auf ein anderes klassisches DMARD empfiehlt, sondern die Kombination klassischer DMARDs. Die Autoren räumen aber ein, dass der Vorteil einer Step-up-Kombination gegenüber der sequentiellen Monotherapie mit klassischen DMARDs nach MTX-Versagen nicht belegt ist.4 Auch für die Frage des optimalen Vorgehens nach Versagen der Ersttherapie besteht dringend weiterer Klärungsbedarf. Beim derzeitigen Kenntnisstand scheinen uns besonders bei ungünstiger Prognose Biologika in diesen Situationen Mittel der Wahl zu sein.
Wenn ein Biologikum bei Versagen der Erstbehandlung verordnet wird, soll es wegen besserer Therapieerfolge möglichst mit MTX kombiniert werden.2-4,10,21 Kombinationen mit anderen klassischen DMARDs sind bislang wenig untersucht und auch nicht zugelassen. Mittel der Wahl unter den Biologika sind im Allgemeinen TNF-alfa-Blocker, mit denen die größten Erfahrungen vorliegen.2 Aussagekräftige direkte Vergleichsstudien zwischen den TNF-alfa-Blockern gibt es nicht. Nach indirekten Vergleichen sind Etanercept und Certolizumab möglicherweise effektiver und Etanercept möglicherweise sicherer als andere TNF-alfa-Blocker.22-24 Solche indirekten Vergleiche müssen aber mit großer Vorsicht interpretiert werden. In die Auswahl sind daher Erprobungsgrad
und Zulassungsstatus des Mittels sowie Kontraindikationen, Begleiterkrankungen und Applikationsform einzubeziehen.4
Wegen ihres geringeren Erprobungsgrades gelten Rituximab, Abatacept und Tocilizumab im Allgemeinen als Biologika der zweiten Linie, wenn auch ein TNF-alfa-Hemmer versagt hat oder nicht vertragen wird. Für alle drei gibt es Wirksamkeitsbelege für Patienten nach unzureichendem Ansprechen auf TNF-alfa-Hemmer. Direkte Vergleiche untereinander sind auch hier nicht vollständig publiziert. Im indirekten Vergleich ist die Wirksamkeit ähnlich.25 Nach Beobachtungsdaten kann in diesen Situationen auch ein Wechsel auf einen anderen TNF-alfa-Hemmer erfolgversprechend sein.26 Im randomisierten Vergleich ist Golimumab bei mit anderen TNF-alfa-Hemmern vorbehandelten Patienten geprüft,27 ebenfalls mit ähnlicher Wirksamkeit wie die drei Biologika der zweiten Linie.25 Allerdings haben in dieser Studie nur 58% der Teilnehmer den zuvor angewendeten TNF-alfa-Blocker wegen unzureichender Wirksamkeit abgesetzt.27
Der Interleukin-1-Antagonist Anakinra wirkt im indirekten Vergleich schwächer als andere Biologika.22 Die Leitlinien der EULAR sowie der DGRh zählen Anakinra nicht zu den erstrangigen Biologika bei rheumatoider Arthritis.2,4 Das britische NICE empfiehlt, Anakinra nur im Rahmen kontrollierter Studien zu verwenden.28
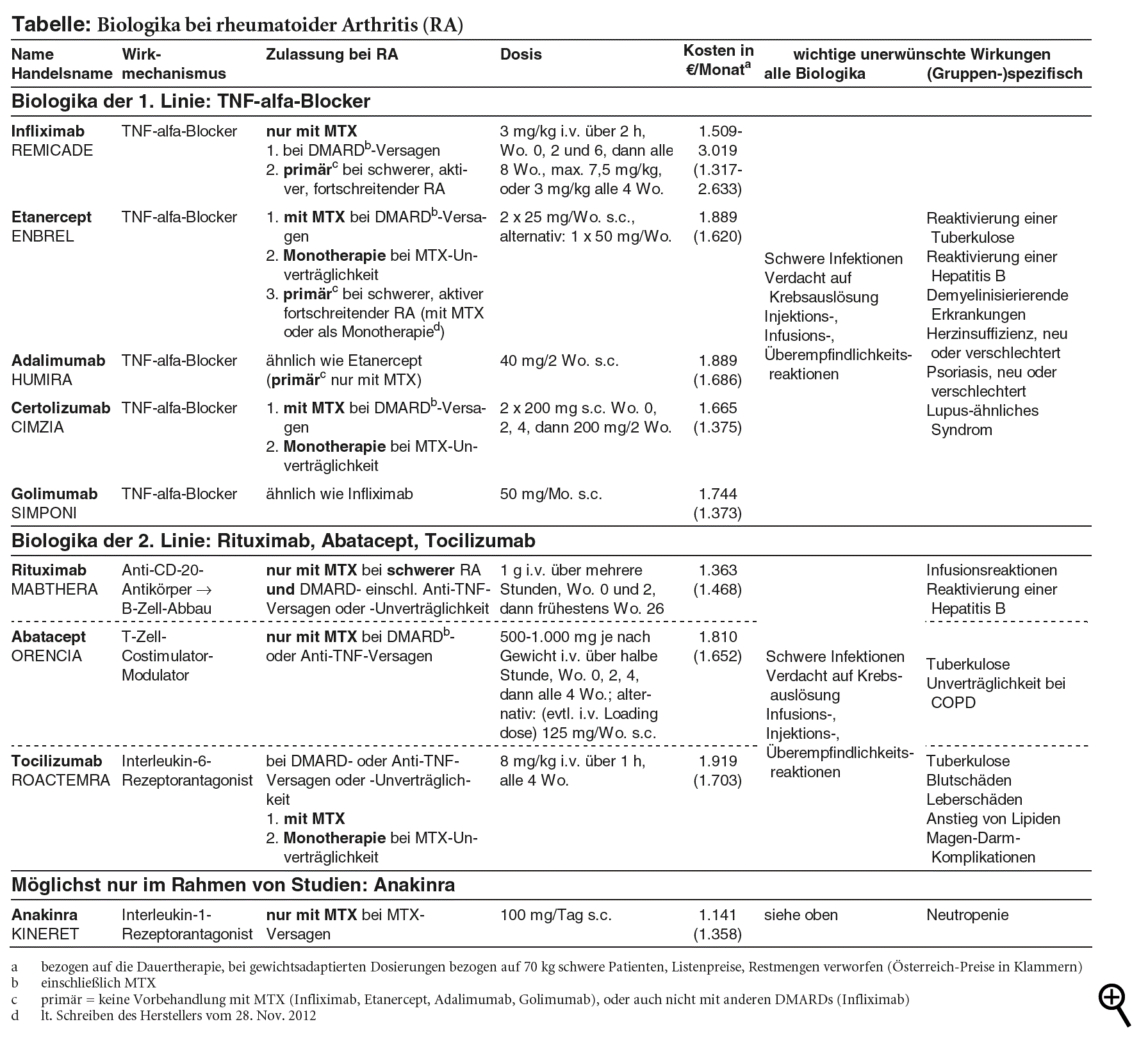
UNERWÜNSCHTE EFFEKTE VON BIOLOGIKA: Erste Hinweise darauf, dass TNF-alfa-Hemmer das Risiko schwerer Infektionen erhöhen können, darunter vor allem Reaktivierung einer Tuberkulose, ergaben sich in der Postmarketing-Überwachung.29 Nach einer Metaanalyse von Beobachtungsstudien nimmt das relative Risiko schwerer Infektionen (RR) unter TNF-alfa-Hemmern um 37% zu (RR 1,37; 95% Konfidenzintervall [CI] 1,18-1,60).30 Nach Registerdaten und einer Metaanalyse randomisierter Studien könnte es auch verdoppelt sein, besonders zu Beginn der Behandlung.29 Die Datenlage ist jedoch nicht einheitlich: So findet eine große US-amerikanische Beobachtungsstudie ein erhöhtes Risiko stationär behandelter Infektionen bei rheumatoider Arthritis nur für Infliximab, nicht aber für Etanercept und Adalimumab. Opportunistische Infektionen und Tuberkulose wurden hier allerdings nicht mit erfasst.31 Aktive Tuberkulose und andere schwere Infektionen sind absolute Kontraindikationen für TNF-alfa-Hemmer. Patienten müssen zudem auf latente Tuberkulose gescreent werden, und bei positivem Befund muss vor Therapiebeginn eine antituberkulotische Prophylaxe eingeleitet werden,32-36 die über neun Monate fortgeführt werden muss. Wegen Reaktivierung einer Hepatitis B und möglicher Verschlechterung einer Hepatitis C unter den Mitteln sollen (Risiko-)Patienten auch auf Virushepatitis gescreent werden.29 Während und nach der Behandlung sind alle Patienten auf Infektzeichen hin zu überwachen, bei Auftreten einer schweren Infektion muss die Therapie unterbrochen werden.32-36
Auch die Biologika der zweiten Linie und Anakinra stehen im Verdacht, das Infektionsrisiko zu erhöhen. Vorbestehende schwere Infektionen sind auch hier Kontraindikationen37-39 bzw. sollten es - bei Anakinra - trotz fehlender entsprechender Angaben in der Fachinformation40 unseres Erachtens sein. Abatacept bedeutet ein besonderes Risiko für Patienten mit chronisch obstruktiver Lungenerkrankung (COPD), bei denen unter anderem Exazerbationen zunehmen.38,41 Tocilizumab wird aktuell mit auffälliger Häufung von nekrotisierender Fasziitis in Verbindung gebracht.42 Unter Abatacept und Tocilizumab ist auch Tuberkulose beschrieben. Vor Therapiebeginn müssen die Patienten entsprechend gescreent und gegebenenfalls antituberkulotisch behandelt werden.38,39 Ob Rituximab mit erhöhtem Tuberkuloserisiko einhergeht, ist unklar. Aus der Behandlung von Patienten mit Lymphomen ergeben sich keine entsprechenden Hinweise. Rituximab kann aber zur Reaktivierung einer Hepatitis B führen. Screening auf Hepatitis B bzw. B und C wird auch für die Biologika der zweiten Linie empfohlen.37,44,45 Unter Rituximab wird zudem Verminderung der Immunglobuline im Serum beobachtet.43 Erniedrigtes IgG unter Rituximab geht nach Registerdaten mit erhöhtem Risiko schwerwiegender Infektionen einher.46 Vor Therapiebeginn sollen die Immunglobuline bestimmt werden,37 nach einer britischen Leitlinie auch vier bis sechs Monate nach der Infusion und vor jeder weiteren Behandlung.46 Entwicklung einer progressiven multifokalen Leukoenzephalopathie (PML) unter Rituximab (vgl. a-t 2009; 40: 32) ist inzwischen auch bei Patienten mit rheumatoider Arthritis beschrieben (geschätzte Häufigkeit 1: 25.000).47 Lebendimpfstoffe dürfen während der Therapie mit Biologika wie auch anderen DMARDs nicht verwendet werden.5,32-40
Immunsuppressiva stehen im Verdacht, das Krebsrisiko zu erhöhen. Die meisten Daten liegen auch hier zu TNF-alfa-Blockern vor. Nach einem systematischen Review ergibt sich in Beobachtungsstudien kein Anstieg der Tumorrate insgesamt, meist aber eine numerische Zunahme von lymphoproliferativen malignen Erkrankungen und nichtmelanotischem Hautkrebs.48 In einer Metaanalyse randomisierter kontrollierter Studien findet sich ein nichtsignifikanter Anstieg von Lymphomen unter den Mitteln (pro 1.000 Patientenjahre 1,65 versus 0,36; p = 0,093).49 Nach einer weiteren Metaanalyse randomisierter kontrollierter Studien ist das relative Risiko von nichtmelanotischem Hautkrebs etwa verdoppelt (RR 2,02; 95% CI 1,11-3,95). Die Lymphomrate ist numerisch geringfügig erhöht.50 Die Daten zu Abatacept und Tocilizumab reichen zur Beurteilung nicht aus.38,39,41Die begrenzten Daten zu Rituximab bei rheumatoider Arthritis weisen nicht auf ein erhöhtes Malignomrisiko. Ein erhöhtes Risiko solider Tumoren kann aber derzeit nicht ausgeschlossen werden.37
Injektions- bzw. Infusions- und Überempfindlichkeitsreaktionen, darunter auch schwerwiegende Überempfindlichkeit, sind unter allen neun Biologika beschrieben.32-40,51 Die intravenös infundierten Biologika dürfen nur in Notfallbereitschaft verabreicht werden.32,37,39,52,53 Besonders häufig (über 30%) sind Infusionsreaktionen unter Rituximab, bei denen es sich zum Teil wahrscheinlich um ein Zytokin-Freisetzungssyndrom handelt. Die inzwischen vorgeschriebene Prämedikation mit Analgetikum, Antihistaminikum sowie intravenösem Methylprednisolon (URBASON, Generika) soll Häufigkeit und Schwere der Ereignisse mindern.37
Zu den weiteren Störwirkungen von TNF-alfa-Blockern gehören demyelinisierende Erkrankungen, Neuauftreten oder Verschlechterung einer Psoriasis, Blutschäden wie Panzytopenie, lupusähnliches Syndrom, interstitielle Lungenerkrankung und Leberschäden. Eine Herzinsuffizienz kann hervorgerufen oder verschlechtert werden. Bei schwerer Herzinsuffizienz (NYHA III-IV) sind die Antikörper kontraindiziert, bei Etanercept ist Vorsicht geboten.32-36 Schwerwiegende kardiale Effekte sind gelegentlich auch unter Rituximab aufgetreten. Bei Herzinsuffizienz NYHA IV oder anderen schweren Herzerkrankungen ist Rituximab kontraindiziert. Rituximab kann auch bei rheumatoider Arthritis Neutropenie auslösen einschließlich schwerer, spät auftretender und anhaltender Ereignisse. Beschrieben ist zudem Serumkrankheit-ähnliches Syndrom.37 Tocilizumab ruft häufig Blutbild- (Neutropenie, Thrombopenie) und Leberwertveränderungen hervor. Die Dosis muss gemäß den Laborwerten angepasst werden. Sehr häufig steigen unter Tocilizumab die Blutfettwerte an. Gelegentlich sind insbesondere bei vorbestehender Divertikulose gastrointestinale Perforation einschließlich Peritonitis, Abszesse oder Fisteln beschrieben.39,52
KOSTEN: Methotrexat (LANTAREL, Generika) ist nicht nur das besterprobte, sondern auch das kostengünstigste DMARD bei rheumatoider Arthritis: Wöchentlich 20 mg per os gibt es pro Monat ab 9 €. Die monatlichen Kosten für täglich 400 mg Hydroxychloroquin (QUENSYL) belaufen sich auf 17 €, die für täglich 2 g Sulfasalazin (AZULFIDINE RA, Generika) auf 23 € bis 31 €. Dagegen werden die biologischen DMARDs überwiegend für mindestens 1.500 € pro Monat angeboten, also mindestens 160-mal teurer als Methotrexat.
Mittel der Wahl zur Basistherapie der rheumatoiden Arthritis ist nach wie vor Methotrexat (LANTAREL, Generika). Bei aktiver Erkrankung sollte zur Erstbehandlung möglichst immer Methotrexat angewendet werden, und zwar - abgesehen von Glukokortikoiden - als Monotherapie.
Biologika haben in der Erstbehandlung keinen hinreichend belegten Vorteil gegenüber dem Beginn mit Methotrexat allein und werden hier in der Regel auch nicht empfohlen.
Bei unzureichendem Ansprechen auf Methotrexat dämpft die Kombination mit einem Biologikum die Krankheitsaktivität stärker als Methotrexat allein. Sie wirkt hier auch besser als die Kombination von klassischen DMARDs.
Insbesondere bei Patienten mit ungünstigen prognostischen Faktoren und Versagen der Ersttherapie sind Biologika Mittel der Wahl. Sie sollten möglichst mit Methotrexat kombiniert werden.
Wegen des höheren Erprobungsgrades sollten unter den Biologika vorrangig Tumornekrosefaktor (TNF)-alfa-Hemmer verwendet werden. Direktvergleiche fehlen. Wir ziehen im Allgemeinen wegen der im indirekten Vergleich besseren Verträglichkeit Etanercept (ENBREL) vor.
Wegen ihres geringeren Erprobungsgrades erachten wir Rituximab (MABTHERA), Abatacept (ORENCIA) und (Tocilizumab (ROACTEMRA) als Biologika der zweiten Linie. Anakinra (KINERET) sollte wegen seiner schwächeren Wirksamkeit möglichst nur innerhalb kontrollierter Studien verwendet werden.
Zu den wichtigsten unerwünschten Effekten der Biologika bei rheumatoider Arthritis gehören schwere Infektionen. Aktive Infektionen sind eine Kontraindikation für die Mittel. Die Biologika stehen im Verdacht, Krebs zu erzeugen. Injektions-, Infusions- und Überempfindlichkeitsreaktionen sind unter allen diesen Mitteln beschrieben.
| (R =randomisierte Studie, M = Metaanalyse) | |
| 1 | SMOLEN, J.S. et al.: Ann. Rheum. Dis. 2010; 69: 631-7 |
| 2 | SMOLEN, J.S. et al.: Ann. Rheum. Dis. 2010; 69: 964-75 |
| 3 | SCHNEIDER, M. et al.: Interdisziplinäre Leitlinie Management der frühen rheumatoiden Arthritis, Stand Aug. 2011 http://www.awmf.org/uploads/tx_szleitlinien/ 060-002l_S3_Management_fr%C3%BChe_rheumatoide_Arthritis_2011-10.pdf |
| 4 | Deutsche Gesellschaft für Rheumatologie: Handlungsempfehlungen der DGRh zur sequenziellen medikamentösen Therapie der rheumatoiden Arthritis 2012; adaptierte EULAR Empfehlungen und aktualisierter Therapiealgorithmus; http://dgrh.de/fileadmin/media/ Praxis___Klinik/Leitlinien/2012/leitlinie_s1__medikamentoese_therapie_ra.pdf |
| 5 | Pfizer: Fachinformation LANTAREL, Stand Juli 2012 |
| M 6 | SUAREZ-ALMAZOR, M.E. et al.: Methotrexate for treating rheumatoid arthritis. Cochrane Database of Systematic Reviews, Stand Nov. 1997; Zugriff Nov. 2012 |
| R 7 | STRAND, V. et al.: Arch. Intern. Med. 1999; 159: 2542-50 |
| 8 | SALLIOT, C., Van der HEIJDE, D.: Ann. Rheum. Dis. 2009; 68: 1100-4 |
| 9 | Prescrire Internat. 2010; 19: 30-4 |
| M 10 | NAM, J.L. et al.: Ann. Rheum. Dis. 2010; 69: 976-86 |
| M 11 | GAUJOUX-VIALA, C. et al.: Ann. Rheum. Dis. 2010; 69: 1004-9 |
| 12 | GORTER, S.L. et al.: Ann. Rheum. Dis. 2010; 69: 1010-4 |
| R 13 | BAKKER, M.F. et al.: Ann. Intern. Med. 2012; 156: 329-39 |
| R 14 | TODOERTI, M. et al.: Ann. N. Y. Acad. Sci. 2010; 1193: 139-45 |
| R 15 | SVENSSON, B. et al.: Arthritis Rheum. 2005; 52: 3360-70 |
| R 16 | SOUBRIER, M. et al.: Rheumatology 2009; 48: 1429-34 |
| R 17 | MORELAND, L.W. et al.: Arthritis Rheum. 2012; 64: 2824-35 |
| M 18 | KATCHAMART, W. et al.: Ann. Rheum. Dis. 2009; 68: 1105-12 |
| R 19 | Van VOLLENHOVEN, R.F. et al.: Lancet 2009; 374: 459-66 |
| R 20 | Van VOLLENHOVEN, R.F. et al.: Lancet 2012; 379: 1712-20 |
| 21 | ALBRECHT, K. et al. : Z. Rheumaol. 2012; 71: 604-18 |
| M 22 | SINGH, J.A. et al.: CMAJ 2009; 181: 787-96 |
| M 23 | SCHMITZ, S. et al.: Ann. Rheum. Dis. 2012; 71: 225-30 |
| M 24 | AALTONEN, K.J. et al.: PLoS one 2012; 7: e30275 (14 Seiten) |
| M 25 | SCHOELS, M. et al.: Ann. Rheum. Dis. 2012; 71: 1303-8 |
| M 26 | REMY, A. et al.: Clin. Exp. Rheumatol. 2011; 29: 96-103 |
| R 27 | SMOLEN, J.S. et al.: Lancet 2009; 374: 210-21 |
| 28 | National Institute for Health and Clinical Excellence: Rheumatoid arthritis. The management of rheumatoid arthritis in adults, Feb. 2009 http://www.nice.org.uk/nicemedia/pdf/CG79NICEGuideline.pdf |
| 29 | British Society for Rheumatology et al.: BSR and BHPR rheumatoid arthritis guidelines on safety of anti-TNF therapies, 2010 http://www.rheumatology.org.uk/includes/documents/ cm_docs/2010/r/ra_guidelines_on_safety_of_antitnf_therapies_sept_2010.pdf |
| M 30 | BERNATSKY, S. et al.: J. Rheumatol. 2010; 37: 928-31 |
| 31 | GRIJALVA, C.G. et al.: JAMA 2011; 306: 2331-9 |
| 32 | MSD: Fachinformation REMICADE, Stand März 2012 |
| 33 | Pfizer: Fachinformation ENBREL, Stand Okt. 2012 |
| 34 | Abbott: Fachinformation HUMIRA, Stand Aug. 2012 |
| 35 | UCB: Fachinformation CIMZIA, Stand Juni 2012 |
| 36 | MSD: Fachinformation SIMPONI, Stand Sept. 2012 |
| 37 | Roche: Fachinformation MABTHERA, Stand Juni 2012 |
| 38 | BMS: Fachinformation ORENCIA Pulver, Stand März 2012 |
| 39 | Roche: Fachinformation ROACTEMRA, Stand Juli 2012 |
| 40 | Sobi: Fachinformation KINERET, Stand Juni 2012 |
| 41 | BMS: US-amerikanische Produktinformation ORENCIA, Stand Dez. 2011 http://www.accessdata.fda.gov/drugsatfda_docs/ label/2012/125118s0138lbl.pdf |
| 42 | Netherlands Pharmacovigilance Centre Lareb: Quartalsbericht Juli 2012 http://www.lareb.nl/getmedia/c e215096-e980-4006-b7fb-6efd3a0c65b5/2012-3-LQR.pdf |
| 43 | FURST, D.E. et al.: Ann. Rheum. Dis. 2012; 71 (Suppl. II): i2-45 |
| 44 | KRÜGER, K. et al.: Empfehlungen zum Einsatz von Abatacept bei Patienten mit rheumatoider Arthritis, 2008; http://dgrh.de/fileadmin/media/Praxis___Klinik/ Therapie-Empfehlungen/abatacept_final.pdf |
| 45 | GAUSE, A. et al.: Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Einsatz von Tocilizumab bei der Rheumatoiden Arthritis, Feb. 2010; http://dgrh.de/fileadmin/media/Praxis___Klinik/ Therapie-Empfehlungen/tocilizumab_korr_endf_feb_2010.pdf |
| 46 | British Society for Rheumatology et al.: BSR and BHPR guidelines on the use of rituximab in rheumatoid arthritis; Febr. 2011; http://rheumatology.oxfordjournals.org/content/suppl/ 2011/05/04/ker106a.DC1/ker106b.pdf |
| 47 | EMA: Transatlantic Workshop on Drug-related Progressive Multifocal Leukoencephalopathy (PML), Juli 2011; http://www.ema.europa.eu/docs/en_GB/document_library/Report/2011/09/WC500111562.pdf |
| 48 | SOLOMON, D.H. et al.: Arthritis Rheum. 2012; 64: 21-32 |
| M 49 | WONG, A.K. et al.: Clin. Rheumatol. 2012; 31: 631-6 |
| M 50 | ASKLING, J. et al.: Pharmacoepidemiol. Drug Saf. 2011; 20: 119-30 |
| 51 | BMS: Fachinformation ORENCIA Injektionslösung, Stand Okt. 2012 |
| 52 | Roche: Rote-Hand-Brief ROACTEMRA vom 2. Dez. 2010 |
| 53 | Deutsche Gesellschaft für Rheumatologie: Therapie mit Abatacept. Eine praxisorientierte Information für den behandelnden Arzt, Stand Aug. 2010 http://dgrh.de/fileadmin/media/Praxis___Klinik/ Therapie-Ueberwachung/Abatacept/abatacept_arzt_10_07_08.pdf |
© 2012 arznei-telegramm, publiziert am 7. Dezember 2012
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
