NEUE DATEN ZU HPV-IMPFSTOFFEN (CERVARIX, GARDASIL)
In einem aktuell publizierten Kommentar zur Impfung gegen humane Papillomviren (HPV), der vom Entdecker der HPV-Genese des Zervixkarzinoms ZUR HAUSEN mitverfasst ist, wird eine Erweiterung der Impfempfehlung auf ältere Frauen, Jungen und Männer gefordert (Titel: “HPV vaccine for all“).1 Ziel müsse die Eradikation der humanen Papillomviren sein. Da diese bei Männern neben Genitalwarzen auch z.B. Penis- und Analkarzinome verursachen, würden auch junge Männer von der Impfung profitieren.1 Belastbare Daten aus klinischen Studien fehlen hierzu jedoch bislang. Neue Daten gibt es aber zum Nutzen der HPV-Vakzinen CERVARIX und GARDASIL bei jungen Frauen:
HPV-16/18-Impfstoff CERVARIX
Der bivalente HPV-Impfstoff CERVARIX enthält Eiweißstrukturen der beiden onkogenen HPV-Typen 16 und 18. Die Zulassung 2007 basierte im Wesentlichen auf der großen Phase-III-Studie PATRICIA*, von der bislang jedoch nur eine Zwischenanalyse mit einer mittleren Nachbeobachtungszeit von 15 Monaten vorlag.2,3 Zudem waren damals lediglich potenzielle Krebsvorstufen ausgewertet worden, in denen HPV 16 oder 18 nachgewiesen wurden und auch nur bei Frauen, die eingangs nicht mit diesen Typen infiziert waren. Daten zum Einfluss auf die Gesamtrate höhergradiger Zervixdysplasien (CIN2+) fehlten bislang, ebenso eine Auswertung aller Studienteilnehmerinnen, unabhängig von ihrem HPV-Status zu Studienbeginn (a-t 2007; 38: 101-3).
| * | PATRICIA = Papilloma trial against cancer in young adults |
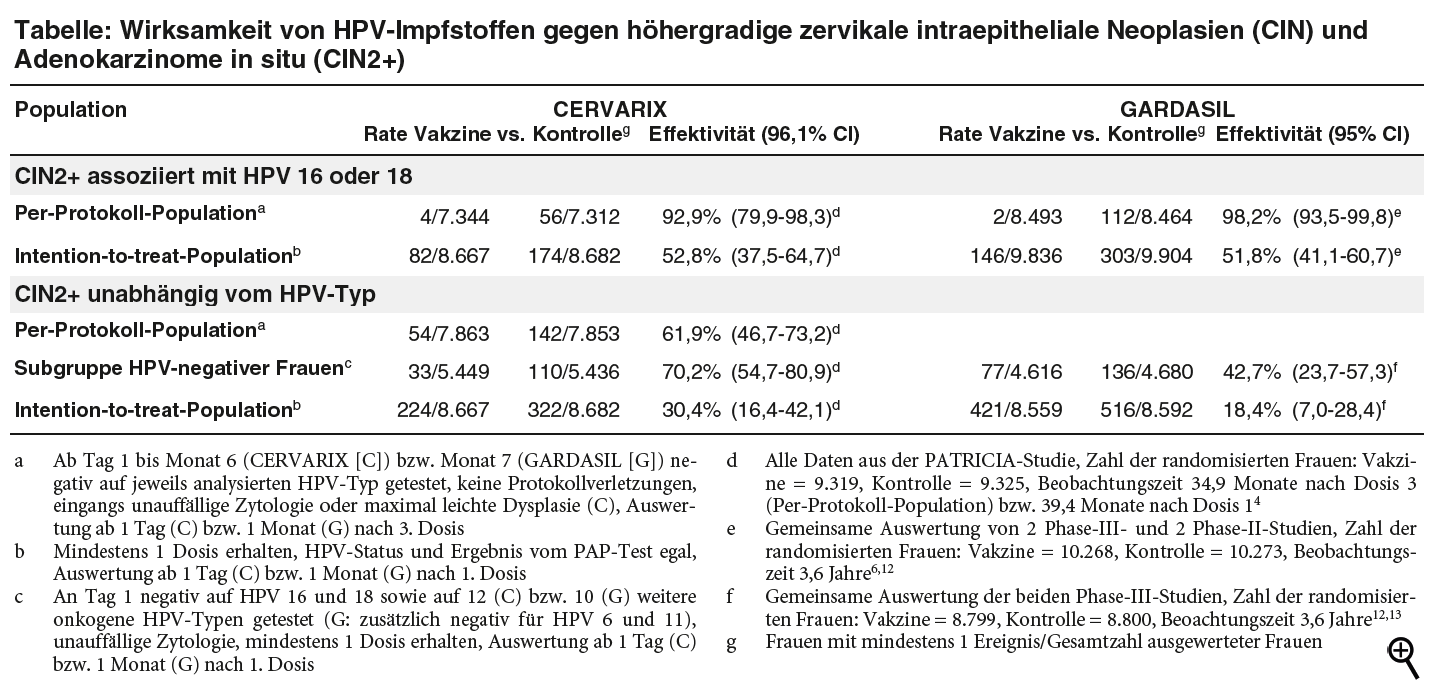
Jetzt wird die Endauswertung der PATRICIA-Studie4 veröffentlicht: An der multizentrischen doppelblinden Studie haben 18.729 junge Frauen zwischen 15 und 25 Jahren teilgenommen, die zuvor höchstens sechs verschiedene Sexualpartner hatten. Die Aufnahme erfolgt unabhängig vom HPV-Status und dem Ergebnis eines eingangs durchgeführten PAP-Tests. Frauen mit einer Kolposkopie oder einem Eingriff an der Zervix in der Vorgeschichte sind jedoch ausgeschlossen. Als Kontrolle dient eine in Erprobung befindliche Formulierung eines Hepatitis-A-Impfstoffs.2,4 Primärer Endpunkt ist die Rate höhergradiger Zervixdysplasien, in denen die Impf-HPV-Typen 16 oder 18 nachgewiesen werden, bei Frauen, die bis zum Abschluss der Grundimmunisierung nicht mit den entsprechenden Typen infiziert waren und nicht gegen das Protokoll verstoßen haben (Per-Protokoll-Population). Während einer mittleren Nachbeobachtungszeit von knapp drei Jahren werden solche Läsionen bei diesen Frauen um 93% reduziert und die Gesamtzahl der CIN2+, unabhängig vom HPV-Typ, um 62% (von 1,8% auf 0,7%, siehe Tabelle Seite 72). In der Gesamtgruppe der Studienteilnehmerinnen (Intention-to-treat [ITT]-Population), die Frauen mit und ohne eingangs bestehende Infektionen mit HPV einschließlich der Typen 16 und 18 umfasst, sinkt die Rate der mit HPV-16/18-assoziierten CIN2+ um 53% und die CIN2+-Gesamtrate um 30% (von 3,7% auf 2,6%).4
Wie bei den Studien mit GARDASIL wird eine weitere Population gebildet, die der Zielgruppe für die HPV-Impfung, junge Mädchen vor dem ersten Geschlechtsverkehr, möglichst nahe kommen soll. Ausgewählt werden daher nur die Teilnehmerinnen (62% der Gesamtgruppe), die eingangs weder mit HPV 16 und 18 noch mit zwölf weiteren onkogenen HPV-Typen (also zwei zusätzliche Typen im Vergleich zu GARDASIL) infiziert sind und einen unauffälligen zytologischen Befund aufweisen. In dieser Subgruppe weitgehend HPV-negativer Frauen reduziert CERVARIX die Gesamtrate höhergradiger Zervixdysplasien um 70% (von 2,0% auf 0,6%).4 Sowohl in dieser Untergruppe als auch in der Gesamtgruppe werden unter CERVARIX signifikant weniger Eingriffe am Gebärmutterhals vorgenommen (z.B. ITT-Population: Vakzine 2,1%, Kontrolle 2,8%, relative Reduktion um 25%). Schließlich wird für verschiedene Populationen eine signifikante Verminderung von CIN2+ durch einige nicht im Impfstoff enthaltene, vorwiegend mit HPV 16 verwandte onkogene HPV-Typen, vor allem HPV 31, bei zuvor nicht mit dem entsprechenden Typ infizierten Frauen errechnet (kreuzprotektiver Effekt).4
Ein beträchtlicher Mangel der Publikation ist die Vielzahl der ausgewerteten Endpunkte, wobei unklar bleibt, welche sekundär bzw. explorativ sind und welche überhaupt prädefiniert waren. Die Angaben in der Veröffentlichung und im Studienregister ClinicalsTrials.gov5 stimmen hier nicht überein.** Zudem werden vier verschiedene Populationen definiert, in denen die Frauen bei einigen Analysen zum Teil zusätzlich nach HPV-Status zu Studienbeginn stratifiziert werden, sodass weitere Untergruppen entstehen. Diese “Flut” von Auswertungen beeinträchtigt nicht nur die Lesbarkeit, sondern begünstigt auch Zufallsbefunde und schwächt daher die Aussagekraft der Ergebnisse, zumal nicht einmal für multiples Testen adjustiert wird.
| ** | Aus dem Studienregister geht auch hervor, dass das Protokoll 2007 geändert wurde und beispielsweise persistierende Infektionen mit HPV 16 oder 18, ursprünglich eines der primären Studienziele, jetzt als sekundärer Endpunkt analysiert werden.14 |
Kaum beurteilen lässt sich die Verträglichkeit von CERVARIX. Der Impfstoff enthält ein neuartiges Adjuvans, Monophosphoryl Lipid A (MLP), das zur weiteren Erhöhung der Immunogenität an Aluminiumhydroxid gebunden ist. MLP findet bislang lediglich in einem weiteren zugelassenen Impfstoff des Herstellers Verwendung, der Hepatitis-B-Vakzine FENDRIX (hierzulande nicht im Handel). Befürchtet wird, dass unter CERVARIX auch Autoimmunerkrankungen zunehmen könnten. Die Kontrollgruppe der PATRICIA-Studie hat jedoch eine in Erprobung befindliche Zubereitung eines Hepatitis-A-Impfstoffs erhalten, zu der keine näheren Informationen vorliegen. Das Ergebnis der Studie, dass sich die Raten unerwünschter Effekte einschließlich schwerwiegender Ereignisse, chronischer oder Autoimmunerkrankungen in beiden Gruppen nicht unterschieden haben,4 bleibt daher ohne Aussagekraft. Studien, in denen CERVARIX mit einer Kochsalzlösung verglichen wird, gibt es unseres Wissens nicht.
HPV-6/11/16/18-Impfstoff GARDASIL
Bereits seit 2008 wird dem HPV-Impfstoff GARDASIL in der Fachinformation eine kreuzprotektive Wirksamkeit bescheinigt, die für Erkrankungen durch HPV-Typen mit phylogenetischer Verwandtschaft zu HPV 16, insbesondere HPV 31, nachgewiesen sein soll, nicht aber für HPV-Typen, die mit HPV 18 verwandt sind.6*** Inzwischen liegen diese Daten vollständig veröffentlicht vor.7,8 Sie stammen aus weiteren Auswertungen der beiden Phase-III-Studien FUTURE**** 1 und 2.9,10 Untersucht wird der Einfluss der Vakzine auf mindestens sechs Monate anhaltende Infektionen oder intraepitheliale Neoplasien aller Schweregrade (CIN1+) durch verschiedene Kombinationen onkogener HPV-Typen in mehreren Untergruppen. Da jedoch mehrere primäre Endpunkte analysiert werden und zudem nach Darstellung des europäischen Beurteilungsberichts (EPAR)11 mehrere Reanalysen durchgeführt wurden, weil die Behörde eines der ursprünglichen Zielkriterien, nämlich vier Monate anhaltende Infektionen, nicht akzeptiert hat - worüber die Publikationen schweigen -, beurteilen wir die Aussagekraft der Ergebnisse als gering. Ohnehin erachten wir die Gesamtrate höhergradiger Zervixdysplasien, unabhängig vom HPV-Typ, als entscheidendes Zielkriterium. Relevante kreuzprotektive Effekte sollte dieser Endpunkt abbilden. In den USA wird nach einer eigenen Analyse der Rohdaten durch die zuständigen Behörden12 in der US-amerikanischen Produktinformation von GARDASIL explizit darauf hingewiesen, dass ein Schutz vor Erkrankungen durch nicht im Impfstoff enthaltene HPV-Typen nicht belegt ist.13
| *** | Mit HPV 16 verwandt sind HPV 31, 33, 35, 52 und 58. Mit HPV 18 verwandt sind HPV 39, 45, 59 und 68. Die größten strukturellen Übereinstimmungen bestehen bei HPV 31 bzw. HPV 45. Insgesamt werden derzeit 18 Typen als onkogen eingestuft. |
| **** | FUTURE = Females United to Unilaterally Reduce Endo/Ectocervical Disease |
Obwohl beide Phase-III-Studien längst beendet sind, liegen aktualisierte Daten zum Einfluss von GARDASIL auf die Gesamtrate der CIN2+ bzw. mit HPV-16/18-assoziierten Läsionen weiterhin nicht vollständig veröffentlicht vor (vgl. a-t 2008; 39: 92-4). In der Tabelle (siehe oben) haben wir die Ergebnisse dargestellt, die in deutschen und US-amerikanischen Fach- bzw. Produktinformationen6,13 mitgeteilt werden.
Auch bei GARDASIL lässt sich die Verträglichkeit in kontrollierten Studien kaum beurteilen, da die Kontrollgruppen überwiegend das Adjuvans (amorphes Aluminiumhydroxyphosphatsulfat) erhalten haben.13
Im Hinblick auf höhergradige intraepitheliale Neoplasien der Zervix (CIN2+), die mit HPV 16 oder 18 assoziiert sind, unterscheiden sich die Daten zur Effektivität der beiden HPV-Impfstoffe CERVARIX und GARDASIL nicht wesentlich.
Bezogen auf die Gesamtrate höhergradiger Dysplasien, unabhängig vom HPV-Typ, scheinen die Daten für CERVARIX günstiger zu sein.
Ob aber die bivalente Vakzine CERVARIX tatsächlich Vorteile bietet, beispielsweise aufgrund stärkerer kreuzprotektiver Effekte, lässt sich durch einen indirekten Vergleich nicht klären. Größere Unterschiede hinsichtlich der Ein- und Ausschlusskriterien und der Basisdaten der untersuchten Frauen sind zwar nicht erkennbar. Es fällt aber auf, dass die Ereignisraten in den Kontrollgruppen der GARDASIL-Studien durchweg höher sind als in der Kontrollgruppe der PATRICIA-Studie, beispielsweise in der ITT-Population für den Endpunkt CIN2+ unabhängig vom HPV-Typ um 60% (6,0% vs. 3,7%).
Zu fordern ist ein unabhängig von den Herstellern durchgeführter Vergleich der beiden HPV-Vakzinen, in dem primär das wichtigste Zielkriterium, die CIN2+-Gesamtrate unabhängig vom HPV-Typ, untersucht wird.
| (R = randomisierte Studie) | ||
| 1 | MICHELS, K.B., ZUR HAUSEN, H.: Lancet 2009; 374: 268-70 | |
| R | 2 | PAAVONEN, J. et al.: Lancet 2007; 369: 2161-70 |
| 3 | EMEA: Europ. Beurteilungsbericht (EPAR) CERVARIX, Stand Okt. 2007 http://www.emea.europa.eu/humandocs/PDFs/EPAR/cervarix/H-721-en6.pdf | |
| R | 4 | PAAVONEN, J. et al.: Lancet 2009; 374: 301-14 |
| 5 | ClinicalTrials.gov: Studie NCT00122681, Stand 7. Mai 2009 http://clinicaltrials.gov/ct2/show/NCT00122681 | |
| 6 | Sanofi Pasteur MSD: Fachinformation GARDASIL, Stand März 2009 | |
| R | 7 | BROWN, D.R. et al.: J. Infect. Dis. 2009; 199: 926-35 |
| R | 8 | WHEELER, C.M. et al.: J. Infect. Dis. 2009; 199: 936-44 |
| R | 9 | GARLAND, S.M. et al.: N. Engl. J. Med. 2007; 356: 1928-43 |
| R | 10 | The FUTURE II Study Group: N. Engl. J. Med. 2007; 356: 1915-27 |
| 11 | EMEA: Europ. Beurteilungsbericht (EPAR) GARDASIL, Stand 15. Juli 2008 http://www.emea.europa.eu/humandocs/PDFs/EPAR/gardasil/GARDASIL-H-703-II-06-AR.pdf | |
| 12 | FDA: Clin. Review GARDASIL, 11. Sept. 2008; http://www.fda.gov/ downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM111274.pdf | |
| 13 | Merck (USA): US-am. Produktinformation GARDASIL, Stand Dez. 2008 | |
| 14 | ClinicalTrials.gov: Studie NCT00122681, Stand 22. Dez. 2007 http://clinicaltrials.gov/archive/NCT00122681/2007_12_22 |
© 2009 arznei-telegramm, publiziert am 1. August 2009
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
