HPV-IMPFSTOFFE (GARDASIL U.A.): NUTZEN WEITER UNKLAR
Eine aktuelle US-amerikanische Kosten-Nutzen-Analyse zur Impfung gegen humane Papillomviren (CERVARIX, GARDASIL) rückt erneut die Diskussion um die vielen offenen Fragen dazu in den Vordergrund. Die Immunisierung 12-jähriger Mädchen kostet demnach gegenüber alleinigem Screening auf Zervixkarzinom pro qualitätskorrigiertem Lebensjahr (Quality adjusted life year [QALY*]) knapp 43.600 $ (30.000 €) zusätzlich und liegt damit unterhalb der in den USA häufig herangezogenen Grenze für Kosteneffektivität von 50.000 $.** Dies gilt jedoch nur unter der Voraussetzung, dass die Impfung lebenslange Immunität bewirkt. Ein reduziertes Risiko von Erkrankungen durch andere Hochrisiko-HPV-Typen (Kreuzimmunität) hätte nur marginale Effekte auf das Kosten-Nutzen-Verhältnis. Dagegen wäre die Impfung bereits bei einer Zunahme von Infektionen mit diesen Typen um 5% (Replacement) nicht mehr kosteneffektiv. Nachholimpfungen Jugendlicher und junger Frauen (bis 18, 21 bzw. 26 Jahre) kosten generell mehr als 50.000 $ pro QALY, selbst wenn positive Effekte der zusätzlichen Impfung gegen HPV 6 und 11 (nur GARDASIL) auf die Inzidenz von Genitalwarzen eingerechnet werden.1
| * | QALY = Maßeinheit, die die durch eine medizinische Intervention gewonnenen Lebensjahre unter Berücksichtigung der Auswirkungen auf die Lebensqualität ausdrückt. Dabei wird die Lebenserwartung mit einem Qualitätsindex (Faktor q) gewichtet, der Werte zwischen 1 (vollständiges Wohlbefinden) und 0 (Tod) annehmen kann.13 |
| ** | Eine wissenschaftliche Basis für einen bestimmten Grenzwert, ab wann eine medizinische Maßnahme noch bzw. nicht mehr als kosteneffektiv gilt, gibt es nicht. In den USA werden häufig 50.000 $ (circa 34.000 €) pro QALY angesetzt. Beim britischen NICE gelten Interventionen, die weniger als 20.000 £ (circa 25.000 €) pro QALY kosten, als in der Regel kosteneffektiv, während Maßnahmen mit einem Kosten-Nutzen-Verhältnis über 30.000 £ (circa 40.000 € ) nur unter besonderen Bedingungen positiv beurteilt werden. |
Kosten-Nutzen-Analysen lassen sich nur bedingt auf andere Länder übertragen. Die aktuelle Untersuchung verdeutlicht aber den Stand des Nichtwissens hinsichtlich der Auswirkungen der HPV-Impfung: Wird die Vakzine tatsächlich die Gesamtzahl höhergradiger Dysplasien der Zervix senken? Und werden auch Karzinome und Todesfälle abnehmen? Wie lange wird der Schutz andauern? Steigt das Krebsrisiko, wenn Frauen sich erst im höheren Lebensalter mit HPV 16 oder 18 infizieren? Welchen Einfluss hat die Impfung auf Infektionen mit anderen onkogenen HPV-Typen? Wie wird sie sich auf vorpubertäre Mädchen auswirken, die in kontrollierten Studien bislang nur in begrenzter Zahl und über einen kurzen Zeitraum auf ihre Immunantwort untersucht wurden? Wie werden sich Screening- und Sexualverhalten geimpfter Frauen verändern?1,2 Die Mehrzahl der Fragen wird sich, wenn überhaupt, erst im Laufe von Jahrzehnten beantworten lassen. Statt groß angelegte Impfprogramme zu starten, die sich auf unbelegte Annahmen stützen, sollten wir uns lieber darauf konzentrieren, in Langzeitstudien solide Antworten zu finden, kommentiert die Herausgeberin des Journal of the Norwegian Medical Association in einem begleitenden Editorial.2 Auch eine Studienleiterin, die an klinischen Studien mit beiden HPV-Impfstoffen beteiligt war, kritisiert die rasche breite Einführung von GARDASIL und macht das aggressive Marketing des US-amerikanischen Anbieters Merck & Co dafür verantwortlich: "Mercks Lobbyarbeit schloss jeden Meinungsbildner, jede Frauengruppe, jede medizinische Fachgesellschaft sowie Politiker ein, und sie gingen direkt auf die Leute zu - es entstand ein Gefühl der Panik, die besagte, du musst diese Vakzine jetzt haben."3 Und sie ist überzeugt, dass mindestens eine, vermutlich aber mehrere Auffrischimpfungen erforderlich sein werden. In klinischen Studien sollen einige Mädchen bereits nach drei Jahren nicht mehr geschützt gewesen sein.3
Für CERVARIX ist eine Abschätzung des Nutzens derzeit praktisch überhaupt nicht möglich, da veröffentlichte Daten der entscheidenden klinischen Studie nach wie vor nur für einen mittleren Beobachtungszeitraum von 15 Monaten vorliegen (vgl. a-t 2007; 38: 101-3). Aber auch bei GARDASIL fällt auf, dass Daten aus klinischen Studien zum Teil nicht offengelegt werden. Dies betrifft zum einen den veröffentlichten Stand der Kenntnis insgesamt: Bei der Markteinführung im Oktober 2006 waren die beiden wesentlichen klinischen Studien, FUTURE*** 1 und 2, noch nicht publiziert (a-t 2006; 37: 117-9). Die Beurteilung der europäischen Arzneimittelbehörde4 basierte auf einem Datenstand von August 2005 und einem mittleren Follow-up von zwei Jahren (1,5 Jahre nach Abschluss der Grundimmunisierung). Die im Mai 2007 veröffentlichten Studien5,6 berücksichtigen Daten bis Juni 2006, entsprechend einer durchschnittlichen Nachbeobachtungszeit von ca. drei Jahren, ebenso der im Mai 2008(!) aktualisierte europäische Beurteilungsbericht (European Public Assessment Report [EPAR]).7 Geplant war jedoch ein vierjähriges Follow-up.4 Zwar wurden ab Anfang 2007 auch Frauen der Plazebogruppen mit GARDASIL geimpft. Nach Unterlagen, die ein Mitarbeiter von Merck US-amerikanischen Behörden im Februar 2008 präsentierte,8 wurde aber letztlich eine mittlere Nachbeobachtungszeit von 44 Monaten realisiert. Wann werden diese Daten vollständig publiziert?
| *** | FUTURE = Female United To Unilaterally Reduce Endo/Ectocervical Disease |
Nach wie vor unklar ist zudem, wie die HPV-Vakzine die Gesamtrate höhergradiger Zervixdysplasien (CIN2 und höher), unabhängig vom HPV-Typ, in der für die Prüfung der Wirksamkeit primär definierten Population beeinflusst, also bei jungen Frauen, die sich bis zum Abschluss der Grundimmunisierung nicht mit Impfstoff-HPV-Typen infiziert haben und keine Protokollverletzungen aufweisen (Per-Protokoll-Population). Eine von der US-amerikanischen Arzneimittelbehörde FDA beim GARDASIL-Hersteller Merck während des Zulassungsverfahrens angeforderte Analyse9 lässt bei diesen Frauen nach zweijährigem Follow-up lediglich eine numerische Reduktion solcher Läsionen um 17% erkennen (siehe Tabelle). Neuere Daten finden wir nicht. Im ursprünglichen EPAR von 2006 wurden dagegen nur Ergebnisse "ergänzender Analysen" für eine von mehreren Subgruppen erwähnt, von denen nicht einmal bekannt ist, ob sie überhaupt vorab festgelegt wurden: Frauen, die zu Studienbeginn mit keinem der vier Impfstoff-HPV-Typen infiziert sind und die einen negativen PAP-Test haben (RMITT-2, Tabelle). Bei ihnen verringert der Impfstoff die Gesamtrate höhergradiger Zervixdysplasien signifikant um 38%.4 Die Aussagekraft von Subgruppenanalysen wird allerdings dadurch geschmälert, dass der Randomisierungseffekt nicht mehr gesichert ist und bereits eingangs bestehende Unterschiede in den Plazebo- und Verumgruppen einen Nutzen vortäuschen können. Nach Einschätzung der FDA lässt sich den Daten nicht hinreichend entnehmen, in welchem Ausmaß höhergradige Zervixdysplasien durch nicht im Impfstoff enthaltene HPV-Typen die Reduktion von Dysplasien durch Impfstoff-HPV-Typen aufwiegen.9 Für die in der aktuellen Fassung des EPAR angeführte Auswertung7 nach dreijähriger Nachbeobachtung wurde diese Subgruppe zudem nochmals verändert: Sie schließt nur noch Frauen ein, die nachträglich negativ auf zehn weitere Hochrisiko-HPV-Typen getestet wurden und umfasst nur noch etwas mehr als die Hälfte der ursprünglich randomisierten Teilnehmerinnen (RMITT-2, neu). Das Ergebnis, eine signifikante Senkung der Gesamtrate höhergradiger Zervixdysplasien um 46%, wird in der aktualisierten Fachinformation von GARDASIL10 ohne Hinweis auf den explorativen Charakter dieser Analyse mitgeteilt.
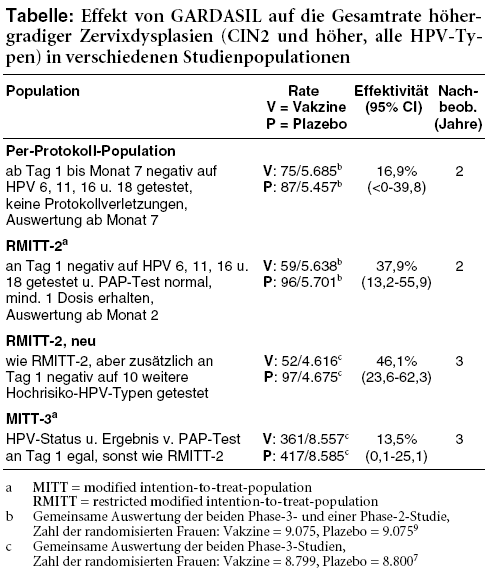
Die Vielzahl der Untergruppen und Analysen erschwert eine Beurteilung des Nutzens der HPV-Vakzine erheblich. Sie dienen zweifelsohne dem Zweck, der Zielgruppe, Mädchen, die noch keinen Geschlechtsverkehr hatten, möglichst nahe zu kommen. Ob dies gelingen kann, ist aber auch angesichts der Übertragungswege humaner Papillomviren fraglich. Da eine Infektion auch über die Haut erfolgen kann, können auch präpubertäre Mädchen bereits infiziert sein.11 Um valide Aussagen zu erhalten, hätte daher genau diese Gruppe in den Zulassungsstudien untersucht werden müssen. Stattdessen wurden - vermutlich, um rascher Ergebnisse zu erhalten - 16- bis 23-Jährige eingeschlossen. Und wahrscheinlich aus Marketinggründen wurden die Studien so konzipiert, dass als klinischer Endpunkt nur der Einfluss der Vakzine auf Dysplasien durch die enthaltenen HPV-Typen 16 und 18 festgelegt wurde und nicht auf die Gesamtrate der Zervixdysplasien. Ohnehin steht die Übertragbarkeit der Ergebnisse auf die Praxis auch deshalb infrage, weil das in den Studien praktizierte Screening nicht dem üblichen Vorgehen entspricht: In drei von vier Studien wurden die Abstrichuntersuchungen in halbjährlichen Abständen vorgenommen, und viele Frauen waren unter 20 Jahre alt und damit noch nicht in dem Alter, in dem Früherkennung auf Zervixkarzinom empfohlen wird. Aus diesem Grund ist die kumulative Inzidenz beispielsweise von CIN-2-Dysplasien in den Zulassungsstudien sehr hoch im Vergleich mit den im Routinescreening gefundenen Raten.12
Der Nutzen der Impfung gegen humane Papillomviren (GARDASIL u.a.) ist nach wie vor offen. Ob, und wenn ja, in welchem Ausmaß, sie schwere Zervixdysplasien, Karzinome und Todesfälle verhindert, wird erst nach Jahrzehnten bekannt sein.
Da in die Zulassungsstudien nicht diejenigen eingeschlossen wurden, für die die Impfung eigentlich bestimmt ist, nämlich präpubertäre Mädchen, die noch keinen Geschlechtsverkehr hatten, muss jetzt auf zumindest zum Teil nachträglich definierte Subgruppenanalysen zurückgegriffen werden. Diese erlauben jedoch aufgrund ihres explorativen Charakters keine validen Aussagen.
Noch schlechter ist die Datenlage für CERVARIX: Auch fast ein Jahr nach der Zulassung umfassen die veröffentlichten Daten der entscheidenden Zulassungsstudie nur einen durchschnittlichen Beobachtungszeitraum von 15 Monaten.
Junge Mädchen, die gegen HPV geimpft werden wollen, sind über die offenen Fragen beispielsweise hinsichtlich des tatsächlichen Nutzens, der Dauer des Schutzes und die möglichen Interaktionen der Vakzine mit anderen onkogenen HPV-Typen zu informieren.
Bestrebungen, möglichst viele Mädchen möglichst schnell zu impfen, halten wir beim jetzigen Kenntnisstand für nicht gerechtfertigt.
| (R = randomisierte Studie) | ||
| 1 | KIM, J.J., GOLDIE, S.J.: N. Engl. J. Med. 2008; 359: 821-32 | |
| 2 | HAUG, C.J.: N. Engl. J. Med. 2008; 359: 861-2 | |
| 3 | HARPER, D., zit. nach ROSENTHAL, E.: The New York Times vom 20. Aug. 2008 | |
| 4 | EMEA: Europ. Beurteilungsbericht (EPAR) GARDASIL, Stand Okt. 2006
zu finden unter: http://www.emea.europa.eu/htms/human/epar/g.htm | |
| R | 5 | FUTURE II Study Group: N. Engl. J. Med. 2007; 356: 1915-27 |
| R | 6 | GARLAND, S.M. et al.: N. Engl. J. Med. 2007; 356: 1928-43 |
| 7 | EMEA: Europ. Beurteilungsbericht (EPAR) GARDASIL, Stand Mai 2008 http://www.emea.europa.eu/humandocs/PDFs/EPAR/gardasil/EMEA-H-703-II-13-AR.pdf | |
| 8 | HAUPT, R.M.: Diapräsentation beim Treffen d. Centers of Disease Control (CDC) u. d. Advisory Committee on Immunization Practices (ACIP); Febr. 2008; http://www.cdc.gov/vaccines/recs/acip/downloads/mtg-slides-feb08/14-3-hpv.pdf | |
| 9 | FDA: Vaccines and Related Biological Products Advisory Committee (VRBPAC) Background Document, Mai 2006 http://www.fda.gov/ohrms/dockets/ac/06/briefing/2006-4222B3.pdf | |
| 10 | Sanofi Pasteur MSD: Fachinformation GARDASIL, Stand Juli 2008 | |
| 11 | HARPER, D., zit. nach BEVINGTON, C.: http://www.kpcnews.com/articles/2007/03/14/online_features/hpv_vaccine/hpv01.txt | |
| 12 | European Centre for Disease Prevention and Control: Guidance for the introduction of HPV Vaccines in EU countries, Jan. 2008 http://ecdc.europa.eu/en/files/pdf/Publications/0801_HPV_guidance.pdf | |
| 13 | SCHLANDER, M.: Kassenarzt 2006; Nr. 7: 24-5 |
© 2008 arznei-telegramm, publiziert am 12. September 2008
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
