Omeprazol "mit unserem Patent-Schutz"
assoziierten wir, als Astra im Dezember 1998 ANTRA MUPS auf den Markt brachte, angeblich die zweite ANTRA-Generation. Inzwischen haben
wir erfahren, dass MUPS "multiple unit pellet system" bedeuten und "noch
zuverlässiger" wirken soll.1 Den Beleg einer klinischen Überlegenheit bleibt Astra uns auf Anfrage schuldig. MUPS-Tabletten wurden im
verkürzten Verfahren unter Bezug auf Daten für die alten Kapseln zugelassen. Ein schwedisches Gericht erkennt jedoch nur die Gleichwertigkeit und
nicht die Überlegenheit von MUPS Tabletten an. Damit scheiterte der Versuch, per Gericht den Import konventioneller ANTRA Kapseln zu verhindern.
Typischerweise fällt die "Optimierung" von ANTRA in die Phase des Patentablaufes. Neben Lobbying und Einlegen von Rechtsmitteln3
("Marketing by Law") gehört Produktprofilierung durch Pseudoinnovationen zu den Strategien, nachdrängenden Wettbewerb zumindest
vorübergehend kleinzuhalten.

Lobbyisten sorgten beispielsweise dafür, dass durch die Direktive 87/21 in der EU die Anmeldung eines Generikums innerhalb von zehn Jahren nach der
ersten Genehmigung des Originals ausgeschlossen ist, wenn Bezug auf Daten des Original-Herstellers genommen wird.3 Prompt versucht Astra, eine
Verwertungsschonfrist für ANTRA MUPS zu beanspruchen. Die Firma moniert, dass sich Nachfolgeanbieter bei der Zulassung auf Studien bezogen haben
sollen, die Astra 1994 im Rahmen des Stufenplans zu ANTRA eingereicht hat. Diese sollten das Risiko von Sehstörungen und Blindheit in Verbindung mit
Omeprazol prüfen (vgl. a-t 1 [1999], 19).
Wie sich die Bilder gleichen: 1982 ersetzte Boehringer Mannheim in Deutschland das 5 mg Glibenclamid haltige EUGLUCON 5 durch die 3,5-mg-
N-Variante mit mikronisiertem Wirkstoff. Die damit verbundene Zwangsumstellung aller Patienten vor Ablauf des Glibenclamid-Patentes begründete der Konzern
mit "entscheidenden Vorteilen" bis hin zu angeblich geringerer Nebenwirkungsrate.4 Da EUGLUCON auch heute noch in zahlreichen
Ländern wie Österreich und der Schweiz nur in der alten 5-mg-Form erhältlich ist, darf man solche Behauptungen getrost als Marketinglatein abtun.
Nachfolgeanbieter konnten bei Patentablauf dennoch ebenfalls 3,5-mg-Produkte anbieten. Das - damals noch aktivere - Bundeskartellamt sorgte zudem wegen der
marktbeherrschenden Stellung von EUGLUCON für niedrigere Preise des Originals - wahrscheinlich langfristig sogar zum Nutzen der Firma: EUGLUCON N
gehört heute zu den wenigen Erstanbieter-Produkten, die trotz langjähriger Konkurrenz durch Generika noch marktführend sind. Dies schaffte Astra
auch für das Metoprolol-Original BELOC dank der bei Patentablauf eingeführten Retard-Variante BELOC ZOK (ZOK =
Zero Order Kinetics), die für konstante Metoprolol-Spiegel sorgen soll und ebenfalls therapeutisch ohne relevanten Vorteil ist.
Zur Rubrik Produktprofilierung kurz vor Patentablauf rechnen wir auch die komplette Umstellung von Doxazosin-Antihypertensiva (DIBLOCIN,
CARDULAR) durch Astra/Pfizer auf retardierte PP-Zubereitungen (a-t 10 [1998], 93). Wer heute
Nachfolgepräparate verordnen will, muss die Patienten wieder auf Normalzubereitungen umstellen.
GlaxoWellcome versuchte 1995, Nachfolgeanbieter von Ranitidin (ZANTIC) durch Androhung von Patentschutzverfahren zu behindern, und warf ihnen
"schlechte Produktions- und Haltbarkeitsqualitäten" vor (a-t 8 [1995], 82). Die
ordnungsgemäße Qualität der Nachfolgeprodukte ist inzwischen belegt (a-t 11 [1998], 100).
Meist ist Patentablauf gleichbedeutend mit drastischem Umsatzrückgang. So verbuchte GlaxoWellcome 1998 weltweit Umsatzverluste für ZANTIC von
42%.5
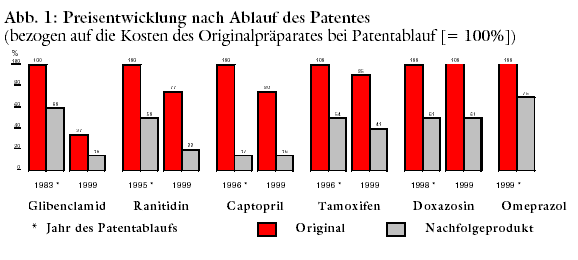
Der Wettbewerbsdruck spiegelt sich in der Preisentwicklung wider. Selbst das Glibenclamid-Original EUGLUCON - damals Synonym für teure Arzneimittel
("Neunmal teurer als Gold") - wird heute zwei Drittel günstiger angeboten als 1983. Nachfolgeanbieter ermöglichen eine weitere
Kostenhalbierung (Abbildung 1).
Preiswettbewerb kommt bisweilen nur langsam in Gang. Die ersten Nachfolgeprodukte sind dann relativ teuer. Bei Omeprazol lassen sich derzeit "nur"
25% einsparen (siehe Kostenvergleich). Bei einem Jahresumsatz 1998 von rund 600 Millionen DM für ANTRA über Apotheken stehen damit immerhin rund
150 Millionen DM für andere Zwecke zur Disposition. Firmen wie Hexal haben bereits weitere - mäßige - Preisnachlässe
angekündigt.
Pseudoinnovationen bei Patentablauf spiegeln auch einen Strukturwandel im Management der Pharmakonzerne wider, in denen Marketing-Experten mehr zu
sagen haben als Wissenschaftler.

|



