 SCHWEINEGRIPPE: ALLES IM GRIFF?
SCHWEINEGRIPPE: ALLES IM GRIFF?
* Vorversion am 25. Aug. 2009 als blitz-a-t veröffentlicht.
Bereits wenige Tage, nachdem die ersten Erkrankungen an Schweinegrippe in Mexiko diagnostiziert worden waren, bezeichnete der Berater der britischen Regierung Sir Roy ANDERSON die Viruserkrankung als Pandemie. Gleichzeitig betonte er, dass zur Behandlung "zwei effektive antivirale Mittel" zur Verfügung stehen.1 Was er nicht mitteilte, ist, dass er jährlich umgerechnet 136.000 € als Lobbyist von GlaxoSmithKline bezieht2 - dem Produzenten des Neuraminidasehemmers Zanamivir (RELENZA) und des Pandemie-Grippeimpfstoffes PANDEMRIX3.
Am 11. Juni 2009 - 45 Tage nach Bekanntwerden der ersten Infektionen - erklärt die Weltgesundheitsorganisation (WHO) die Schweinegrippe tatsächlich zur Pandemie. Obgleich dieser Schritt nach WHO-eigener Definition nichts über die Bedrohlichkeit der Infektion aussagt, sondern nur etwas über ihren Verbreitungsgrad, setzt er automatisch national wie international weitere "Krisen"-Maßnahmen in Gang. Hierzulande war er unter anderem Startschuss für die Vorbereitungen zur Massenimpfung. Der nationale Pandemieplan des Robert Koch-Instituts beschreibt eine Influenzapandemie als "lang anhaltende, länderübergreifende Großschadenslage", die "derart nachhaltige Schäden verursacht, dass die Lebensgrundlage zahlreicher Menschen gefährdet oder zerstört wird".4
In Deutschland sollen bislang rund 18.000 Menschen an der Schweinegrippe, die auch als Mexikanische oder neue Grippe beziehungsweise als pandemische (H1N1) 2009 Influenza oder A(H1N1)v bezeichnet wird, erkrankt (gewesen) sein. Die Dunkelziffer dürfte erheblich sein. 75% bis 80% der Infektionen wurden im Ausland erworben. Die Schweinegrippe verläuft hierzulande in der Regel mild und unkompliziert. Bislang sind in Deutschland keine Todesfälle erfasst.5 Dies steht im Kontrast zur "normalen" saisonalen Virusgrippe, der jährlich tausende Tote zugeschrieben werden - allerdings auf einer Datenbasis, deren Validität nicht nachvollziehbar ist (a-t 2008; 39: 101-2). Während bei einer saisonalen Grippe vor allem Ältere gefährdet sind, erkranken an Schweinegrippe vor allem unter 25-Jährige. In Deutschland und anderen Ländern lässt sich seit wenigen Wochen ein Trend erkennen, dass die Zahl neu erfasster Erkrankungen rückläufig ist.5
Politiker und Behörden stehen in der Pflicht, bei einer drohenden Pandemie Vorbereitungen für den Ernstfall zu treffen. Die Fürsorgepflicht zum Schutz der Bürger schließt aber auch ein, dass die Behörden angemessen und flexibel auf den sich abzeichnenden Verlauf einer Epidemie reagieren, die Bevölkerung ausgewogen über die tatsächlich zu erwartende Gefährdung informieren und keine unbegründeten Ängste wecken. Die Realität sieht anders aus: Diskussionen um Schulschließungen, Empfehlungen, auf Reisen in betroffene Länder zu verzichten oder die Einrichtung von Quarantänestationen erwecken den Eindruck, dass eine Katastrophe bevorsteht. Die daraus entstehende Besorgnis, eine Art "Concern-Bias", dürfte inzwischen mehr zu Verunsicherung und Verängstigung beitragen als die Schweinegrippe selbst.6
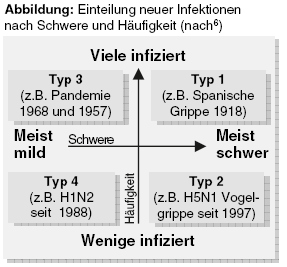
Auch das Paul-Ehrlich-Institut (PEI) schürt in erster Linie Ängste, wenn es für den Herbst schwere Krankheitsfälle und Todesopfer7 prognostiziert. Gefahr im Verzug vermittelt auch der Kommentar des PEI-Präsidenten zu den neuen Impfstoffen: "Wenn wir lange testen, riskieren wir viele Tote".8 Panikgefühl verursachen zudem die alarmierenden Schlagzeilen, die seit Wochen in den Medien dominieren. "Wie die Schweinegrippe im Winter wüten kann, zeigte sich in Argentinien", weiß beispielsweise Die Zeit.9 Solche Schreckensmeldungen basieren auf der simplen Folgerung Pandemie = drohende Welle von Todesfällen. Die tatsächliche Schwere der Infektionen bleibt unberücksichtigt. Eine vorgeschlagene einfache Klassifizierung macht die Unterschiede in der Bedrohlichkeit anschaulich (Abbildung). Die Schweinegrippe wäre demzufolge als Typ-3-Pandemie (häufige und meist milde Infektionen) einzustufen, im Gegensatz beispielsweise zur Vogelgrippe: Typ 2, wenige, aber meist schwere Infektionen.6
Und was wird im kommenden Winter, wenn Schweinegrippeviren und saisonale Grippeviren zusammentreffen? Manches spricht dagegen, dass besonders aggressive Virusmutanten zu erwarten sind: In Australien ist die neue Grippe bereits mit dem Höhepunkt der saisonalen Grippe zusammengefallen, ohne dass auffällig aggressive Verläufe beobachtet wurden. Von dort kommt der Rat an die nördliche Halbkugel: "Nicht überreagieren."10 Auch aufgrund historischer Erfahrungen ist eher damit zu rechnen, dass relevante Pandemien und Pandemie-ähnliche Ereignisse mit der Zeit an Schwere abnehmen.11 Und auch das könnte zur Beruhigung beitragen: Der Versuch an Frettchen (einem etablierten Modell für humane Influenzainfektionen), die mit Schweinegrippeviren plus saisonalen H1N1- oder H3N2-Viren koinfiziert wurden, ergibt keinen Hinweis auf Genaustausch (Reassortment).12
IMPFUNG GEGEN SCHWEINEGRIPPE: "Es wäre unlogisch, nicht gegen H1N1 zu impfen", erläutert der Präsident des PEI die Strategie.13 Die ersten 50 Millionen Dosierungen werden beim gegenwärtigen Kenntnisstand von GlaxoSmithKline geliefert. Dieser Pandemie-Impfstoff beruht auf der Musterzulassung der Vogelgrippevakzine PANDEMRIX.3 Der monovalente inaktivierte Spaltvirusimpfstoff, bei dem jetzt das Vogelvirusantigen gegen Schweinevirusantigen ausgetauscht ist, wird auf Hühnereiern gezogen und enthält lediglich 3,75 µg Antigen statt 45 µg in den trivalenten saisonalen Grippeimpfstoffen (3 x 15 µg). Ermöglicht wird die geringe Antigenmenge durch den Wirkverstärker AS03, eine Öl-in-Wasser-Emulsion, die noch nie zuvor in einem handelsüblichen Impfstoff verwendet worden ist und die aus dem Triterpen Squalen, dem Emulgator Polysorbat 80 und Vitamin E besteht.14 Solche Adjuvanziengemische, die vom PEI verharmlosend als "fast so etwas wie ,Bio-Verstärker'"15,16 bezeichnet werden,** verstärken aber nicht nur die Immunogenität, sondern führen auch zu einer deutlichen Zunahme unerwünschter Lokalreaktionen und systemischer Effekte. In einer Dosisfindungsstudie für PANDEMRIX mit 3,8 µg Vogelgrippeantigenen werden unter adjuvantiertem Impfstoff Schmerzen an der Injektionsstelle bei 90% der Patienten (48 von 51) erfasst, ohne Adjuvans bei 38% (19 von 50), Schwellung bei 20% versus 8%, Ekchymosen bei 16% vs. 8%, Kopfschmerzen bei 53% vs. 36%, Müdigkeit bei 45% vs. 28% und Arthralgie bei 28% vs. 10%.18 Nicht auszuschließen ist, dass das Adjuvanziengemisch auch das Risiko seltener bedrohlicher Schadwirkungen einschließlich Guillain-Barré-Syndrom erhöht.
| ** | Die vom PEI als "Bio-Verstärker" bezeichneten Adjuvanzien sollen - so die Behörde - "laut Zulassungsunterlagen aus biologischen Quellen gewonnen werden", Polysorbat beispielsweise "aus Mais- oder Sonnenblumenöl".16 Das stark emulgierende Polysorbat 80 ist jedoch ein typisches Syntheseprodukt, hergestellt durch Veresterung des Süßmittels Sorbit und seiner Anhydride mit Ölsäure (z.B. aus Sonnenblumenöl) sowie Polymerisation mit Ethylenoxid.17 Die Bezeichnung "Bio" für Polysorbat 80 erachten wir als grob irreführend, -Red. |
Wie unkalkulierbar Hilfsstoffe die Verträglichkeit von Impfstoffen beeinflussen können, zeigt das Beispiel des FSME-Impfstoffs TICOVAC. Diese als besonders gut verträglich eingeführte Vakzine musste 2001 nur 14 Monate nach Markteinführung wegen häufiger und schwerer Schadwirkungen aus dem Handel gezogen werden. Der einzige Unterschied zum Vorläufer FSME-IMMUN IMMUNO bestand darin, dass die Hilfsstoffe Albumin und ein Quecksilberkonservans aus der Rezeptur gestrichen worden waren (a-t 2001; 32: 41-3).
Die US-amerikanische Arzneimittelbehörde FDA setzt bislang bei Pandemie-Impfstoffen - wie auch bei saisonalen Grippe-Vakzinen - auf die bewährte wirkverstärkerfreie Technologie.19,20 Für diese gibt es jahrzehntelange Erfahrungen: Die jährlich mit wechselnden Antigenen produzierte saisonale Grippe-Vakzine dürfte der am häufigsten verwendete Impfstoff sein. Die antigensparende Verwendung von Wirkverstärkern ist - wie das Beispiel USA zeigt - nicht zwangsläufig erforderlich, um die Produktion zu beschleunigen. Da die Pandemie-Vakzinen nur ein Antigen enthalten, wird für die Produktion ohnehin nur ein Drittel der für konventionelle Grippeimpfstoffe erforderlichen Antigenmenge benötigt. Dennoch wollen Firmen wie Baxter, GSK und Novartis auch in den USA adjuvantierte Vakzinen testen.
Adjuvantierte Vakzinen sollen - so das PEI - "nicht nur gegen den im Impfstoff enthaltenen Virusstamm, sondern auch gegen Varianten des Impfvirus" wirken.25 Ob und in welchem Umfang das auf die aktuelle Pandemie-Vakzine zutrifft, bleibt mangels Daten offen. Sollten sich die Viren beispielsweise beim Zusammentreffen der neuen Grippe mit der saisonalen jedoch tatsächlich relevant verändern, dürfte auch der Nutzen der Masssenimpfung infrage stehen.
Die Fokussierung auf neuartige Impfstoffe mit Wirkverstärkern schafft Probleme:
Der Erfahrungshintergrund zur Sicherheit der in Pandemie-Impfstoffen verwendeten Wirkverstärkeremulsionen ist gering. Das PEI verweist zwar auf die Überprüfung der "Kombination eines Influenzaimpfstoffs mit dem Verstärker AS03" in klinischen Studien "bei mehreren zehntausend Menschen" ab 18 Jahren,15 bezieht sich aber auf Nachfrage auf Zulassungsunterlagen, die auch den Wirkverstärker MF59 einschließen und "die vermutlich (noch) nicht veröffentlicht sind".16 Die Daten sind somit nicht nachprüfbar. Jede Firma setzt zudem auf eigene (patentierte) Verstärkermischungen. Sicherheit und Wirksamkeit jeder dieser Emulsionen müssen separat für jeden Impfstoff geprüft und bewertet werden.
Der Übergang von der klinischen Prüfung in die allgemeine Anwendung ist eine besonders sensible Phase des Arzneimittelgebrauchs. Kommt es bei schlagartig breiter Anwendung zu unerwarteten Nebenwirkungen, können sehr viele Menschen betroffen sein, bevor gegengesteuert werden kann. Dass der Pandemie-Impfstoff nach knapper Testung sofort an 25 Millionen Bundesbürger verimpft werden soll, erachten wir daher als bedenklichen Großversuch. Eine epidemiologische Studie, in der eine Assoziation zwischen Guillain-Barré-Syndrom und Grippeimpfung untersucht werden soll,16 und andere Postmarketinguntersuchungen16 befinden sich im Stadium der unverbindlichen Absichtserklärung.
Die adjuvantierte Pandemie-Vakzine soll zweimal verimpft werden. Dass dies tatsächlich erforderlich ist, erscheint nicht gesichert. Die Empfehlung geht auf Erkenntnisse mit den bekannt schlecht immunogenen Vogelgrippeantigenen18,21 zurück. Der theoretische Vorteil der Musterzulassung wird zum Nachteil, wenn beim Austausch der Antigene nicht auch die übrigen Charakteristika wie Dosisregime überprüft und ggf. angepasst werden. Auch müsste zusätzlich ein drittes Mal geimpft werden - gegen die saisonale Grippe. Ob dieses Impfschema von den Deutschen akzeptiert wird, bleibt offen. Die FDA hingegen lässt erst die produzierte Vakzine testen, um dann über die Dosis und das Dosisregime (ein- oder zweimal) zu entscheiden.19,22
SCHWEINEGRIPPE 1976: VERGESSENE LEHREN
1976 erkrankten in Fort Dix (New Jersey, USA) mehr als 200 Rekruten an Atemwegserkrankungen, die auf ein neues Schweinegrippevirus zurückgeführt wurden.1 Unter anderem wegen der beobachteten Mensch-zu-Mensch-Übertragung sprachen sich Behörden und Experten für eine Massenimpfung aus.2,3 In aller Eile begann die Impfstoffproduktion. Aber, so zwei damals verantwortliche Behördenleiter, "statt der Fläschen mit Impfstoff lieferten die Hersteller ein Ultimatum".3 Eine gesetzliche Regelung sollte sie von der Haftung für etwaige unerwünschte Folgen der Impfung freistellen. Sie drohten damit, andernfalls die Produktion einzustellen. Als es auch in Philadelphia zu schweren Atemwegserkrankungen unter älteren Teilnehmern einer Legionärsversammlung kam, unterschrieb Präsident FORD das Gesetz (kurz darauf wurden diese Erkrankungen in Philadelphia als bakterielle Infektion erkannt und Legionärskrankheit genannt). Um Bedenken gegen Risiken der Impfung entgegenzuwirken, ließen sich Präsident FORD und seine Familie zur besten Sendezeit öffentlich impfen. Bald folgten aber die ersten Berichte über Erkrankungen an Guillain-Barré-Syndrom (GBS) in Verbindung mit der Impfung. Als die Kampagne beendet wurde, waren 40 Millionen Menschen geimpft, von denen 532 meist innerhalb von sechs Wochen nach der Impfung an GBS erkrankt und 32 in der Folge gestorben waren.2 Das Virus selbst wurde übrigens nicht aus der Kaserne verschleppt. Dort erkrankten - serologisch bestätigt - 230 Soldaten, einer starb.1
Selbstverständlich können die damaligen Ereignisse nicht 1 : 1 auf die heutige Situation übertragen werden. Die Lehren aus den damaligen Fehlentscheidungen und Trugschlüssen geben aber zu denken. Dazu gehört, dass Impfprogramme in vorher festgelegten Abständen reevaluiert werden sollten, um festzustellen, ob Änderungen oder vielleicht sogar ein Stopp der Maßnahmen erforderlich sind. Externe Überprüfungen tragen zur Sicherheit des Programms bei. Bei der Begründung der eingeschlagenen Strategien muss deutlich unterschieden und kommuniziert werden, welche Empfehlungen auf gesicherten Daten und welche auf Vermutungen beruhen.2
1 ZIMMER, S.M., BURKE, D.S.: N. Engl. J. Med. 2009; 361: 279-85
2 Lessons Learned from 1976 Swine Influenza Program - Draft
http://www.fda.gov/ohrms/dockets/dailys/04/sep04/ 090204/04s-0212-sup0001-15-Draft-Annex-11-vol3.pdf
3 SENCER, D.J., MILLAR, J.D.: Emerg. Infect. Dis. 2006; 12: 29-33
Schwangere sollen nach Erfahrungen aus den USA mit dem neuen Grippeerreger im Vergleich zur Allgemeinbevölkerung ein geschätzt vierfach erhöhtes und mit Dauer der Schwangerschaft zunehmendes Risiko haben, wegen Komplikationen in die Klinik eingewiesen zu werden.23 Diese Hochrechnungen beruhen auf geringen Ereigniszahlen (11 Klinikeinweisungen Schwangerer, 6 Frauen sind gestorben). Erfahrungen aus früheren Pandemien gehen aber in die gleiche Richtung. Die WHO empfiehlt daher, Schwangere zu impfen. In den USA können die Frauen getrost die dortige adjuvansfreie Pandemie-Vakzine erhalten, die auch bei Schwangeren getestet wird.22 Anders in Deutschland. Hier fehlen Erfahrungen zur Sicherheit der adjuvantierten Vakzine. Dies führt zur unhaltbaren Situation, dass klinische Tests bei Schwangeren "aus ethischen Gründen nicht durchgeführt"24 werden, andererseits aber empfohlen wird, Schwangere zu impfen -, also unkontrolliert und ohne Absicherung durch Studien. Ausführliche Erläuterungen des PEI, dass es für die einzelnen Bestandteile der Wirkverstärker und sonstige Hilfsstoffe keine Hinweise auf embryotoxische oder fetotoxische Effekte gibt,24 klammern ein relevantes Problem aus: Die Veränderungen des mütterlichen Immunsystems, die zu einer Tolerierung des Feten führen, können nicht nur mit einer besonderen Gefährdung durch Grippevirusinfektionen einhergehen, sondern durch die Wirkverstärker möglicherweise auch mit häufigeren bzw. schwereren überschießenden Immunreaktionen. Hierzu fehlen Daten. In Deutschland wird Schwangeren - wie auch den übrigen Bürgern - ein konventionell produzierter Pandemie-Impfstoff vorenthalten. Die Empfehlung der hiesigen Pandemie-Vakzine für Schwangere widerspricht unseres Erachtens dem Prinzip des vorbeugenden Verbraucherschutzes.
In der kurzen Erprobungsphase nach der Produktion werden lediglich das Surrogatkriterium Antikörpertiter bestimmt und kurzfristig auftretende Nebenwirkungen an wenigen Probanden untersucht. Auch nach Auskunft von PEI und RKI "geht [es] nicht darum, das Nebenwirkungsprofil zu überprüfen."26 Dieses soll sich - so die Behörden in einem für Vakzinen mit Wirkverstärker schwer nachvollziehbaren Analogschluss - "aus der jahrzehntelangen Anwendung von Grippeimpfstoffen ergeben."26 Bei Bestellung der Pandemie-Impfstoffe wurde keine die Impfaktion begleitende Studie zur Bedingung gemacht, in der der Einfluss der Impfung systematisch auf patientenrelevante Endpunkte geprüft wird, also beispielsweise auf die Häufigkeit von Asthmaanfällen, Pneumonien oder Tod im Vergleich zur Nichtimpfung. Obwohl Hersteller schon im Vorfeld erhebliche öffentliche Gelder für die wissenschaftliche "Weiterentwicklung von Pandemie-Impfstoffen" (damals gegen Vogelgrippe) erhielten,27 ließen sich Bundesgesundheitsministerium und Gesundheitsministerkonferenz unter Druck setzen. GSK mahnte höflich, aber eindeutig: "Angesichts der weltweit großen Nachfrage ... bitten wir Sie ... uns die vertraglich fixierten Bestellungen der Bundesländer unverzüglich ... verbindlich zu bestätigen."28
Die geplante Impfaktion in Deutschland wird mindestens 700 Millionen Euro verschlingen, bei den in Betracht gezogenen Nachbestellungen ggf. bis zu zwei Milliarden Euro - zu viel Geld für einen zweifelhaften Impfstoff gegen eine milde verlaufende Pandemie. Erwartungen, dass der geringere Antigengehalt im Vergleich zur konventionellen Produktion zu deutlich niedrigeren Preisen führt, werden enttäuscht. Der jetzt festgesetzte Preis von 18 € pro Doppelimpfung (zuzüglich zweimal 5 € für das Impfen) liegt sogar über dem Preis der saisonalen Impfung: Diese kostet pro Immunisierung auf der Basis der Herstellerabgabepreise etwa 14 € bei Verwendung einer OP zu 10 Fertigspritzen. Dabei ist der Großauftrag für den Anbieter äußerst kostensparend: Die sonst üblichen Kosten für Verkaufsförderung entfallen. Üblicherweise geben Großkonzerne etwa ein Viertel ihres Umsatzes für den Bereich Marketing und Werbung aus.29 Auch werden lediglich Injektionsflaschen für die Mehrfachentnahme geliefert. Die Vakzine enthält daher das heutzutage weitgehend aus Impfstoffen verbannte Quecksilber-haltige Konservans Thiomersal, das Verkeimung nach Erstöffnung verhindern soll.24
Trotz der Größe des Auftrages sind die damit verbundenen Konditionen nicht öffentlich zugänglich. Wie bei den Rabattverträgen (a-t 2008; 39: 1-3) ist an die Möglichkeit von Interessenkonflikten der Personen zu denken, die die Bedingungen aushandeln.
NEURAMINIDASEHEMMER: Derzeit sind Oseltamivir (TAMIFLU) und Zanamivir (RELENZA) die einzigen Mittel, die zur Prophylaxe und Therapie der Schweinegrippe tatsächlich verfügbar sind. Systematische Erfahrungen zur Wirksamkeit bei der neuen Grippe fehlen jedoch. Ein relevanter Nutzen dürfte nach den Erfahrungen bei saisonaler Grippe unwahrscheinlich sein. Bei Erwachsenen kann Oseltamivir Symptome einer saisonalen Grippe im Median um etwa einen Tag verkürzen, ohne dass ein relevanter Einfluss auf schwerwiegende Komplikationen und Tod durch Influenza nachgewiesen ist (a-t 2005; 36: 62-3).30 Für Schwangere scheint nach Auswertung der begrenzten Daten zumindest kein größeres Schädigungspotenzial (Teratogenität) von Oseltamivir erkennbar zu sein.31 Für Zanamivir liegen diesbezüglich deutlich weniger Erkenntnisse zur Risikobeurteilung vor.31 Nach einer aktuellen Metaanalyse verringern Neuraminidasehemmer auch bei Kindern lediglich die Krankheitsdauer der saisonalen Grippe um etwa einen Tag (im Median 0,5 bis 1,5 Tage) - ebenfalls ohne Beleg für einen relevanten Einfluss auf Komplikationen einschließlich Asthmaanfälle und bakterielle Infektionen.32 Kinder vertragen Oseltamivir zudem schlecht. Sehr häufig sind Magen-Darm-Störungen sowie neuropsychiatrische Störwirkungen wie Albträume, Konzentrationsstörungen sowie Müdigkeit oder Schlafstörungen.33,34 Unkalkulierbare Risiken einschließlich selbstgefährdender Verhaltensstörungen wie Suizid durch Fenstersprung stehen der Anwendung von Oseltamivir bei Kindern und Jugendlichen entgegen (a-t 2007; 38: 40).
Mit zunehmendem Gebrauch von Oseltamivir steigt das Risiko von Resistenzen: Innerhalb weniger Monate entwickelte sich in den USA in der vergangenen Saison eine nahezu vollständige Resistenz der kursierenden saisonalen A-H1N1-Viren, die auch in Deutschland an Verbreitung gewonnen haben (a-t 2009; 40: 21). Im vergangenen Jahr haben sich 19% der A-H1N1-Viren in Europa als Oseltamivir-resistent erwiesen.35 Resistenzentwicklung gegen Oseltamivir ist inzwischen auch bei der Therapie der Schweinegrippe in Europa, Asien und den USA beschrieben.35,36 Resistente Stämme bleiben in der Regel gegen Zanamivir empfindlich. Das ältere Amantadin (Generika) ist gegen die Schweinegrippe wirkungslos.37
Die so genannte Schweinegrippe verläuft in Deutschland nach wie vor in aller Regel klinisch mild. Im Gegensatz dazu vermitteln Mitteilungen von Behörden und Medien ein bedrohliches Szenario, das eine Massenimpfung erfordere.
Der in Deutschland zunächst vorgesehene Pandemie-Impfstoff der Firma GlaxoSmithKline, mit dem im ersten Schritt 25 Millionen Bürger geimpft werden sollen, enthält ein Wirkverstärkergemisch, das bislang nicht in handelsüblichen Impfstoffen verwendet wurde. Dies erachten wir als bedenklichen Großversuch: Solche adjuvantierten Vakzinen werden deutlich schlechter vertragen als konventionelle. Das Risiko seltener schwerer unerwünschter Immunreaktionen ist nicht abgeklärt.
Die amerikanische Arzneimittelbehörde FDA ist vorsichtiger: In den USA werden jetzt Pandemie-Impfstoffe verwendet, die in bewährter Technologie ohne Wirkverstärker hergestellt werden.
Ob die adjuvantierte Vakzine auch gegen Mutanten des Schweinegrippevirus wirkt, bleibt offen.
Wirkverstärkerfreie Pandemie-Impfstoffe wird es in Deutschland nicht geben - auch nicht für Schwangere, für die jegliche Erfahrungen mit der adjuvantierten Vakzine fehlen und die laut offizieller Empfehlung dennoch geimpft werden sollen.
Die Massenimpfung kostet mindestens 700 Millionen Euro - eine bedenkliche Verschwendung von Ressourcen.
Auf welcher Basis die geplanten Maßnahmen entschieden werden, bleibt intransparent. Strategien, die helfen könnten, Schaden abzuwenden, werden nicht eingeschlagen, so etwa eine institutionalisierte externe und öffentliche Kontrolle sowie im Voraus festgelegte regelmäßige Überprüfungen der vorgesehenen Maßnahmen auf Angemessenheit und Notwendigkeit, damit diese gegebenenfalls zeitnah nachjustiert oder sogar abgebrochen werden können.
Verharmlosende Stellungnahmen der Zulassungsbehörde zu den potenziellen Risiken der Pandemie-Impfstoffe lassen eine neutrale Bewertung von Nutzen und Schaden vermissen. Dies erinnert daran, dass die Zulassung von Arzneimitteln und die Nachmarktkontrolle durch voneinander unabhängige Behörden durchgeführt werden sollten (vgl. a-t 2007; 38: 17).
Angesichts des bislang milden Verlaufs der Schweinegrippe und der offenen Fragen zur Sicherheit der Pandemie-Vakzinen raten wir beim derzeitigen Stand des Wissens von der vorgesehenen Massenimpfung ab.
| (R = randomisierte Studie, M = Metaanalyse) | ||
| 1 | BBC Radio 4 Today, 1. Mai 2009 http://news.bbc.co.uk/today/hi/today/newsid_8028000/8028295.stm | |
| 2 | DERBYSHIRE, D.: MailOnline vom 27. Juli 2009; http://www.dailymail.co.uk/news/article-1202389/Government-virus-expert-paid-116k-swine-flu-vaccine-manufacturers.html | |
| 3 | EMEA: Europ. Beurteilungsbericht (EPAR) PANDEMRIX, Stand 18. Aug. 2009; http://www.emea.europa.eu/humandocs/Humans/EPAR/pandemrix/pandemrix.htm | |
| 4 | RKI: Nationaler Pandemieplan, Mai 2007; http://www.rki.de/cln_091/nn_200120/DE/Content/InfAZ/I/Influenza/ influenzapandemieplan__I,templateId=raw,property=publicationFile.pdf/influenzapandemieplan_I.pdf | |
| 5 | GILSDORF, A., POGGENSEE, G.: Eurosurveillance 2009; 14, Nr. 34: 1-4 | |
| 6 | DOSHI, P.: BMJ 2009; 339: b3471, published online 3. Sept. 2009 | |
| 7 | Zitiert nach Berliner Zeitung vom 7. August 2009 | |
| 8 | LÖWER, J., zitiert nach Berliner Zeitung vom 29. Aug. 2009 | |
| 9 | Die Zeit vom 13. August 2009 | |
| 10 | SWEET, M.: BMJ 2009; 339: b3317 | |
| 11 | MORENS, D.M. et al.: N. Engl. J. Med. 2009; 361: 225-9 | |
| 12 | PEREZ, D. et al.: Fitness of Pandemic H1N1 and Seasonal influenza A viruses during Co-infection. PLoS Currents: Influenza. 25. Aug. 2009 | |
| 13 | Ärzte Zeitung vom 10. August 2009 | |
| 14 | GlaxoSmithKline: Schreiben vom 25. Aug. 2009 | |
| 15 | Paul-Ehrlich-Institut: Pressemitteilung vom 29. Aug. 2009 | |
| 16 | Paul-Ehrlich-Institut: Schreiben vom 4. Sept. 2009 | |
| 17 | Hagers Handbuch der Pharmazeutischen Praxis, Band 9, Springer-Verlag Berlin, 5. Aufl. 1993, Seite 289 | |
| R | 18 | LEROUX-ROELS, I. et al.: Lancet 2007; 370: 580-9 |
| 19 | Scrip 2009; Nr. 3456: 22 | |
| 20 | Am. Soc. of Health-Syst. Pharmacists, TRAYNOR, K.: Officials Look Toward Fall for Clinical Data on Pandemic Vaccines, 1. Sept. 2009, AJHP News | |
| R | 21 | TREANOR, J.J. et al.: N. Engl. J. Med. 2006; 354: 1343-51 |
| 22 | Centers for Disease Control: Press Briefing Transcripts, 21. Aug. 2009 http://www.cdc.gov/media/transcripts/2009/t090821.htm | |
| 23 | JAMIESON, D.J. et al.: Lancet 2009; 374: 451-8 | |
| 24 | Paul-Ehrlich-Institut: Pandemieimpfstoffe in der Schwangerschaft, Sicherheitsaspekte, 3. Sept. 2009 | |
| 25 | Paul-Ehrlich-Institut, Fragen und Antworten zu Impfstoffen gegen das pandemische (H1N1) 2009-Virus (Schweinegrippe), Stand 22. Juli 2009 | |
| 26 | Paul-Ehrlich-Institut und Robert Koch-Institut: Gemeinsame Presseerklärung vom 6. Aug. 2009 | |
| 27 | Schutzkommission beim Bundesminister des Inneren: Zwischenbericht vom 25. Sept. 2006, Schutz der Bevölkerung vor neu auftretenden Influenza-Viren | |
| 28 | apotheke adhoc: Hersteller setzte Länder unter Druck, 20. Aug. 2009 | |
| 29 | Europäische Kommission: Zusammenfassung des Berichts über die Untersuchung des Arzneimittelsektors, 16. Juli 2008; http://ec.europa.eu/competition/sectors/pharmaceuticals/inquiry/communication_de.pdf | |
| M | 30 | BURCH, J. et al.: Lancet Infect. Dis. 2009; 9: 537-45 |
| 31 | TANAKA, T. et al.: Can. Med. Ass. J. 2009; 181: 55-8 | |
| 32 | SHUN-SHIN, M. et al.: BMJ 2009; 339: b3127, published online DOI:10.1136/bmj.b3172 | |
| 33 | KITCHING, A. et al.: Eurosurveillance 2009; 14 (30), 4 Seiten | |
| 34 | WALLENSTEN, A. et al.: Eurosurveillance 2009; 14 (30), 4 Seiten | |
| 35 | Scrip 2009; Nr. 2453: 26 | |
| 36 | MMWR 2009; 58 (32): 893-6 | |
| 37 | Deutsche Gesellschaft für Pädiatrische Infektiologie: Aktualisierte Empfehlung der DGPI zur Diagnostik, Therapie und Prophylaxe der Infektion mit dem Neuen Influenza A/H1N1-Virus bei Kindern und Jugendlichen, 20. Aug. 2009; http://www.dgpi.de/pdf/Influenza_A_H1N1_DGPI-Empfehlungen_20Aug2009.pdf |
© 2009 arznei-telegramm, publiziert am 11. September 2009
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
