COVID-19-IMPFSTOFF VON JANSSEN
Seit Mitte März ist in der EU ein vierter Impfstoff gegen COVID-19 für Erwachsene bedingt zugelassen, der Adenovirus-Vektorimpfstoff Ad26.COV2.S (JNJ-78436735) von Janssen, einer Tochterfirma von Johnson & Johnson.1 Anders als die messenger (m)-RNA-Vakzinen von BioNTech/Pfizer (BNT162b2 [COMIRNATY]; a-t 2020; 51: 92, 101-2) und Moderna (mRNA-1273; a-t 2021; 52: 1-4) und der Vektorimpfstoff AZD1222 von AstraZeneca (a-t 2021; 52: 9-13) wird die Vakzine von Janssen als Einmaldosis angewendet.2
EIGENSCHAFTEN: Ad26.COV2.S basiert auf einem modifizierten, nicht vermehrungsfähigen humanen Adenovirus (Serotyp 26), in dessen Genom der Bauplan für das Spike-Protein von SARS-CoV-2 eingefügt wurde.2 Adenoviren sind DNA-Viren und gelten generell als nichtintegrierende Vektoren,3-5 das heißt, sie bauen ihr Erbgut nicht in das menschliche Genom ein. Auch nach natürlicher Infektion mit einem Adenovirus, die als Erkältungsviren weit verbreitet sind, wurde bislang keine genetische Veränderung menschlicher Zellen beobachtet.4 Laut RKI und PEI verbleibt das Genom des Vektorimpfstoffs ebenso wie das anderer Adenoviren im Kern infizierter Zellen extrachromosomal.3,4 Dort wird anhand der DNA mRNA gebildet, nach der dann im Zytoplasma das Virusprotein synthetisiert und anschließend dem Immunsystem präsentiert wird. Dies induziert eine zelluläre Immunreaktion und die Bildung neutralisierender Antikörper.2 In der EU ist bereits ein Ebola-Impfstoff von Janssen (ZABDENO) zugelassen,6 der auf der Adenovirus-26-Plattform basiert, weitere Kandidaten, beispielsweise gegen das Zika-Virus, werden derzeit erprobt. Laut US-amerikanischer Arzneimittelbehörde FDA wurden bis Ende 2020 knapp 194.000 Personen im Rahmen von klinischen Studien oder Impfprogrammen mit einer Adenovirus-26-Vektorvakzine immunisiert.7 Auch beim russischen SARS-CoV-2-Impfstoff SPUTNIK V wird für die Erstimmunisierung dieser Serotyp verwendet.8
| Dosierung | 1 Impfdosis mit 5 x 1010 Viruspartikeln intramuskulär |
| Lagerung | bei 2 °C bis 8 °C oder bis zu 12 Stunden bei Raumtemperatur (bis 25 °C), nach Anbruch muss der Inhalt des Mehrdosisbehälters (5 Impfdosen) innerhalb von 6 Stunden (Lagerung bei 2 °C bis 8 °C) bzw. 27 bis 32 Stunden (Lagerung bis 25 °C) verbraucht werden2,7 |
WIRKSAMKEIT: Der klinische Nutzen von Ad26.COV2.S wird in der laufenden randomisierten doppelblinden Phase-III-Studie ENSEMBLE geprüft, in der knapp 44.000 Erwachsene (45% Frauen) aus den USA (44%), Lateinamerika (41%) und Südafrika (15%) eine Einzeldosis des Vektorimpfstoffs oder Plazebo (Kochsalz) erhalten.* 20% sind mindestens 65 Jahre alt, 3,5% 75 Jahre und älter. 41% haben mindestens eine stabile Vorerkrankung, am häufigsten Übergewicht (BMI > 30 kg/m2, 29%), Bluthochdruck (10%) und Typ-2-Diabetes (7%). Bei 2,8% ist eine HIV-Infektion bekannt.7 Patienten mit Immunsuppression oder bekannter/ vermuteter Allergie gegen Impfstoffe sind ausgeschlossen.9
| * | Da die Studie bislang nicht veröffentlicht ist und auch der europäische Beurteilungsbericht (EPAR) noch nicht vorliegt, stützen wir unsere Bewertung auf das Review7 der FDA. |
Koprimäre Endpunkte sind COVID-19-Erkrankungen ab Tag 15 sowie ab Tag 29 nach Immunisierung, deren Schweregrad als mindestens moderat eingestuft wird,** bei Personen ohne serologischen oder virologischen Nachweis einer SARS-CoV-2-Infektion zu Studienbeginn und ohne Protokollverletzungen (n = 39.321).7,9*** Anders als die Bezeichnung „moderate“ Erkrankung nahelegt, entspricht die Definition weitgehend der des primären Endpunkts „COVID-19-Erkrankung“ in der Zulassungsstudie der Moderna-Vakzine.10 In der europäischen Fachinformation von Ad26.COV2.S ist folgerichtig auch lediglich von „symptomatischem COVID-19“2 die Rede.
| ** | Moderate COVID-19-Erkankung ist definiert als positiver PCR-Test plus mindestens zwei der Symptome Fieber, Herzfrequenz ≥ 90/min, Schüttelfrost, Halsschmerz, Husten, Krankheitsgefühl, Kopfschmerz, Myalgie, gastrointestinale Beschwerden (z.B. Durchfall), Geschmacks- oder Geruchsstörung oder mindestens eines der Symptome Atemfrequenz ≥ 20/min, Kurzatmigkeit, abnorme Sauerstoffsättigung (aber > 93%), klinischer/radiologischer Nachweis einer Pneumonie, tiefe Venenthrombose.7,9 |
| *** | Der Endpunkt „ab Tag 29“ wird am 14. Dez. 2020 nachträglich eingeführt. |
In Subgruppenanalysen werden zur Erhöhung der statistischen Aussagekraft auch COVID-19-Erkrankungen berücksichtigt, bei denen die gemäß Endpunkt-Definition geforderte zentrale Bestätigung des PCR-Tests – laut FDA wegen der hohen Inzidenzrate während der Studie – zum Zeitpunkt der Analyse aussteht. Dies betrifft 32% aller Ereignisse des primären Endpunkts. Die Übereinstimmung zwischen den lokalen Laboren und dem Zentrallabor soll mit 90% hoch sein. Dabei wird für Teilnehmer ab 65 Jahre eine Wirksamkeit von 76,5% ab Tag 15 und von 68,6% ab Tag 29 errechnet. Bei mindestens 75-Jährigen sinkt das Erkrankungsrisiko ab Tag 15 – bei allerdings sehr geringen Ereignisraten (1 versus 9) und daher breitem Konfidenzintervall – um 89,7%. Ab Tag 29 treten in dieser Altersgruppe keine als mindestens moderat eingestuften COVID-19-Erkrankungen mehr auf (vs. 4 unter Plazebo, keine statistische Auswertung). Für Patienten mit Begleiterkrankungen wird eine Schutzrate von 64,2% bzw. 58,6% ermittelt (siehe Tabelle).7
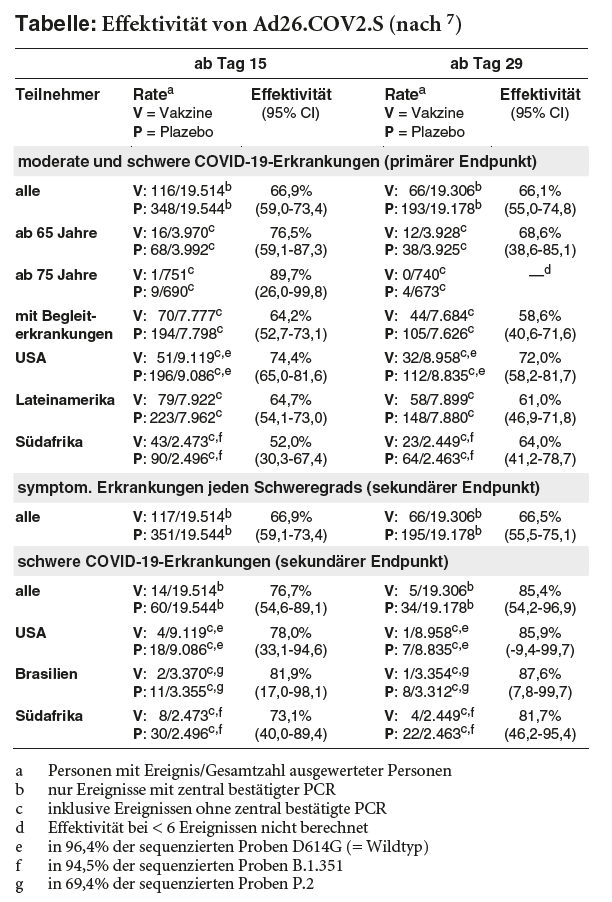
Bei schweren COVID-19-Erkrankungen**** (sekundärer Endpunkt) ist der Effekt des Vektorimpfstoffs in der Gesamtgruppe mit einer errechneten Risikominderung um 76,7% (ab Tag 15) bzw. 85,4% (ab Tag 29) ausgeprägter (siehe Tabelle). Hospitalisierungen wegen COVID-19 insgesamt bzw. Erkrankungen, die aufgrund objektiver (z.B. radiologischer) Befunde eine stationäre oder intensivmedizinische Behandlung, mechanische Beatmung und/oder ECMO erfordern, werden ab Tag 29 nach Immunisierung mit Ad26.COV2.S nicht mehr beobachtet (Plazebo: 6 bzw. 5 zentral bestätigte Hospitalisierungen insgesamt bzw. aufgrund objektiver Befunde sowie weitere 10 bzw. 2 unbestätigte Ereignisse). Mit COVID-19 assoziierte Todesfälle treten unter der Vakzine nicht auf gegenüber 7 in der Plazebogruppe (darunter 1 Patient mit eingangs positiver PCR), alle in Studienzentren in Südafrika.7
| **** | Schwere COVID-19-Erkankung definiert als COVID-19-Erkrankung plus mindestens eines der folgenden Kriterien: klinische Zeichen in Ruhe, die auf eine schwere systemische Erkrankung hinweisen (Atemfrequenz ≥ 30/min, Herzfrequenz ≥ 125/min, Sauerstoffsättigung ≤ 93% u.a.); respiratorisches Versagen (definiert als Bedarf an High-flow-Sauerstoff, nichtinvasiver oder mechanischer Beatmung oder ECMO); Hinweise auf einen Schock; signifikante akute renale, hepatische oder neurologische Dysfunktion; Verlegung auf die Intensivstation oder Tod.7,9 |
Die ENSEMBLE-Studie wird auch in Regionen durchgeführt, in denen sich in den vergangenen Monaten Virusmutationen verbreitet haben. Gegenüber der in Südafrika vorherrschenden Variante B.1.351, die dort in 94,5% der bislang sequenzierten Proben nachgewiesen wird, wird für Ad26.COV2.S zum Teil zwar eine etwas geringere Wirksamkeit ermittelt (52% gegenüber mindestens moderaten Erkrankungen ab Tag 15). Schwere COVID-19-Erkrankungen scheinen aber in Südafrika und auch in Brasilien, wo in knapp 70% der sequenzierten Proben die Virusmutation P.2 entdeckt wird, ähnlich deutlich gemindert zu werden wie in den USA, wo während des analysierten Zeitraums die ursprüngliche Variante D614G dominiert – bei allerdings sehr breiten Konfidenzintervallen (siehe Tabelle). Die „britische“ Mutation B.1.1.7 wurde in der Studie bislang nicht nachgewiesen.7
Insgesamt mindert Ad26.COV2.S symptomatische SARS-CoV-2-Infektionen nach einmaliger Immunisierung innerhalb eines sehr kurzen Beobachtungszeitraums von im Median zwei Monaten im indirekten Vergleich in ähnlichem Ausmaß wie der Vektorimpfstoff von AstraZeneca (Effektivität 60%) und deutlich schlechter als die beiden mRNA-Vakzinen (Effektivität 95%). Im Hinblick auf die Verhinderung schwerer Verläufe scheinen sich die vier Impfstoffe beim jetzigen Kenntnisstand jedoch nicht relevant zu unterscheiden. Die Frage, wie lange der Schutz anhält – die für sämtliche COVID-19-Impfstoffe derzeit ungeklärt ist –, stellt sich für die als Einmaldosis zugelassene Janssen-Vakzine unseres Erachtens besonders. Laut Anbieter legen Daten von anderen Impfstoffen, die auf Adenovirus 26 als Vektor basieren, nahe, dass eine Boosterung eine stärkere und länger anhaltende Immunreaktion hervorrufen könnte.11 Seit November 2020 läuft daher eine weitere Phase-III-Studie (ENSEMBLE 2) mit geplant 30.000 Teilnehmern auch aus Europa einschließlich Deutschland, in der zwei Dosierungen (ebenfalls mit 5 x 1010 Viruspartikeln) im Abstand von acht Wochen ursprünglich mit Plazebo verglichen werden sollten.11,12 Mit Erteilung der Notfallzulassung in den USA möchte Janssen jedoch das Protokoll ändern: Die Kontrollgruppe soll künftig einmalig Ad26.COV2.S erhalten, und auch bereits eingeschlossenen Teilnehmern der Plazebogruppe wird eine Dosis des Vektorimpfstoffs angeboten.7
SICHERHEIT: In die Analysen zur Sicherheit gehen 43.783 Personen ein, die im Median acht Wochen nachbeobachtet werden. Eine Untergruppe (n = 6.736) dokumentiert in einem elektronischen Tagebuch nach der Immunisierung sieben Tage lang typische lokale und systemische Impfreaktionen. Lokalreaktionen treten bei 50,2% (Plazebo 19,4%) im Median zwei Tage nach Impfung auf, halten zwei bis drei Tage an und werden von 0,7% (Plazebo 0,2%) als schwer eingestuft.***** Unter 60-Jährige sind häufiger betroffen als ältere Teilnehmer (60% vs. 35%, schwer: 0,9% vs. 0,4%). Mit Abstand am häufigsten wird über Schmerz an der Injektionsstelle berichtet (< 60 Jahre: 85,6%, ≥ 60 Jahre: 33,3%), gefolgt von Rötung (9% bzw. 4,6%) und Schwellung (7% bzw. 2,7%).7
| 5* | Schwere Intensität: Definition variiert je nach unerwünschtem Ereignis, bedeutet in der Regel aber, dass Alltagsaktivitäten nicht möglich sind.7 |
Systemische Impfreaktionen kommen bei 55,1% vor (Plazebo 35,1%), treten im Median nach zwei Tagen auf, halten ein bis zwei Tage an und werden von 1,8% (Plazebo 0,6%) als schwer eingeschätzt. Auch hier sind jüngere Impflinge eher betroffen als ältere (62% vs. 45%, schwer: 2,3% vs. 1,1%). Beobachtet werden Kopfschmerzen (< 60 Jahre: 44,4%, ≥ 60 Jahre: 30,4%), Müdigkeit (43,8% bzw. 29,7%), Myalgie (39,1% bzw. 24%), Übelkeit (15,5% bzw. 12,3%) und Fieber (12,8% bzw. 3,1%). 26% der unter 60-Jährigen und 10% der Teilnehmer ab 60 Jahre wenden in der Woche nach Immunisierung ein Analgetikum oder Antipyretikum an.7
In der gesamten hinsichtlich Sicherheit ausgewerteten Population werden in den ersten sieben Tagen zudem Arthralgien und Muskelschwäche etwas häufiger berichtet als unter Scheinmedikament. Numerisch häufiger sind auch Urtikaria (bei 5 vs. 1 Teilnehmer). Ein Betroffener entwickelt in der Folge ein Angioödem der Lippen, was als Überempfindlichkeitsreaktion eingeordnet wird. Berichte über Anaphylaxie gibt es in der ENSEMBLE-Studie nicht, ein entsprechendes Ereignis tritt aber in einer anderen, offen durchgeführten Studie auf.7
Ein geringes numerisches Ungleichgewicht fällt zudem im Hinblick auf thromboembolische Ereignisse auf (0,06% vs. 0,05% unter Plazebo), darunter (tiefe) Venenthrombosen (6 vs. 2 Ereignisse) und Lungenembolien (4 vs. 1) sowie eine Sinusthrombose, die zu einem vorübergehenden Stopp der klinischen Erprobung geführt hatte. Ob ein Kausalzusammenhang zwischen Thromboembolien und Impfung besteht, lässt sich laut FDA derzeit nicht klären. Eine Überwachung entsprechender Ereignisse ist vorgesehen.7 Für den Vektorimpfstoff von AstraZeneca wird in Europa aufgrund mehrerer Verdachtsberichte aktuell ein mögliches Risiko venöser Thromboembolien und Sinusthrombosen vom europäischen Pharmakovigilanzausschuss (PRAC) untersucht.13 Impfungen mit AZD1222 sind daher in vielen europäischen Ländern einschließlich Deutschland bei Redaktionsschluss ausgesetzt (siehe Seite 24).14
Numerisch häufiger werden unter Ad26.COV2.S auch Tinnitus (6 vs. 0) und Krampfanfälle (4 vs. 1) beobachtet. Während für die Ohrgeräusche ein ursächlicher Zusammenhang derzeit offen bleibt, hält die FDA diesen bei Krampfanfällen für unwahrscheinlich.7
KOSTEN: Eine Dosis des COVID-19-Impfstoffs von Janssen soll nach einer im Dezember 2020 kurzzeitig von einer belgischen Politikerin auf Twitter verbreiteten Tabelle etwa 7 € kosten.15
Seit Mitte März ist der COVID-19-Impfstoff von Janssen (Ad26.COV2.S) als vierter Impfstoff für Erwachsene in der EU bedingt zugelassen. Der Vektorimpfstoff wird als Einmaldosis verabreicht. Wann die Vakzine hierzulande zur Verfügung stehen wird, ist derzeit offen.
Ad26.COV2.S senkt in einer großen randomisierten Studie innerhalb eines medianen Beobachtungszeitraums von acht Wochen nach Immunisierung die Rate symptomatischer SARS-CoV-2-Infektionen um 66%. Ältere Teilnehmer und solche mit Begleiterkrankungen profitieren ähnlich.
Schwere COVID-19-Erkrankungen werden um bis zu 85% gemindert (5 versus 34 Erkrankungen unter Plazebo). Hospitalisierungen wegen COVID-19 insgesamt sowie solche, die aufgrund objektiver Befunde eine medizinische Intervention erfordern, treten ab Tag 29 nach der Immunisierung nicht mehr auf (Plazebo: 6 bzw. 5 Ereignisse).
Für schwere COVID-19-Erkrankungen wird auch in Südafrika und Brasilien, wo in einem Großteil der bislang sequenzierten Proben die dort verbreiteten Virusmutationen B.1.351 bzw. P.2 nachgewiesen werden, eine Schutzrate von mehr als 80% ermittelt.
Mit Lokalreaktionen, insbesondere Schmerz an der Injektionsstelle, und systemischen Reaktionen wie Kopf- und Muskelschmerzen sowie Müdigkeit ist bei jedem zweiten Geimpften zu rechnen. Unter 60-Jährige sind häufiger betroffen als Ältere.
Überempfindlichkeitsreaktionen sind beschrieben, ebenso ein Bericht über Anaphylaxie in einer offenen Studie.
Thromboembolische Ereignisse fallen unter Ad26.COV2.S numerisch geringfügig häufiger auf als unter Plazebo. Ob ein kausaler Zusammenhang mit der Impfung besteht, lässt sich laut US-amerikanischer Arzneimittelbehörde FDA derzeit nicht bestimmen.
Wie bei den anderen COVID-19-Impfstoffen ist die Nachbeobachtungszeit in der Zulassungsstudie von Ad26.COV2.S kurz und offene Fragen bleiben. Neben potenziellen bislang unbekannten schwerwiegenden Risiken muss unseres Erachtens vor allem die Dauer des Schutzes überwacht werden, da derzeit lediglich eine einmalige Anwendung des neuen Vektorimpfstoffs vorgesehen ist.
| (R = randomisierte Studie) | ||
| 1 | EMA: Pressemitteilung vom 11. März 2021; http://www.a-turl.de/?k=strh | |
| 2 | EMA/Janssen: SPC COVID-19 VACCINE JANSSEN, 11. März 2021; http://www.a-turl.de/?k=aulg | |
| 3 | Paul-Ehrlich-Institut: Schreiben vom 8. März 2021 | |
| 4 | Robert Koch-Institut: COVID-19 und Impfen: Antworten auf häufig gestellte Fragen, Stand 12. März 2021; http://www.a-turl.de/?k=atts | |
| 5 | LEE, C.S. et al.: Genes Dis. 2017; 4: 43-63 | |
| 6 | EMA: Pressemitteilung vom 29. Mai 2020; http://www.a-turl.de/?k=ylda | |
| 7 | FDA: Review Janssen COVID-19 vaccine, 27. Febr. 2021; http://www.a-turl.de/?k=armi | |
| R | 8 | LOGUNOV, D.Y. et al.: Lancet 2021; 397: 671-81 |
| 9 | Janssen: Protokoll ENSEMBLE, Stand Dez. 2020; http://www.a-turl.de/?k=ilse | |
| R | 10 | BADEN, L.R. et al.: N. Engl. J. Med. 2021; 384: 403-16 |
| 11 | Janssen: Protokoll ENSEMBLE 2, Stand Dez. 2020; http://www.a-turl.de/?k=rlan | |
| 12 | Janssen: ClinicalTrials.gov, Stand Febr. 2021; http://www.a-turl.de/?k=einf | |
| 13 | EMA: Pressemitteilung vom 15. März 2021; http://www.a-turl.de/?k=aake | |
| 14 | Paul-Ehrlich-Institut: Pressemitteilung vom 15. März 2021; http://www.a-turl.de/?k=ilde | |
| 15 | BOSSAERT, J.: HLN News vom 17. Dez. 2020; http://www.a-turl.de/?k=urka |
© 2021 arznei-telegramm, publiziert am 19. März 2021
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
