COVID-19-IMPFSTOFF VON MODERNA
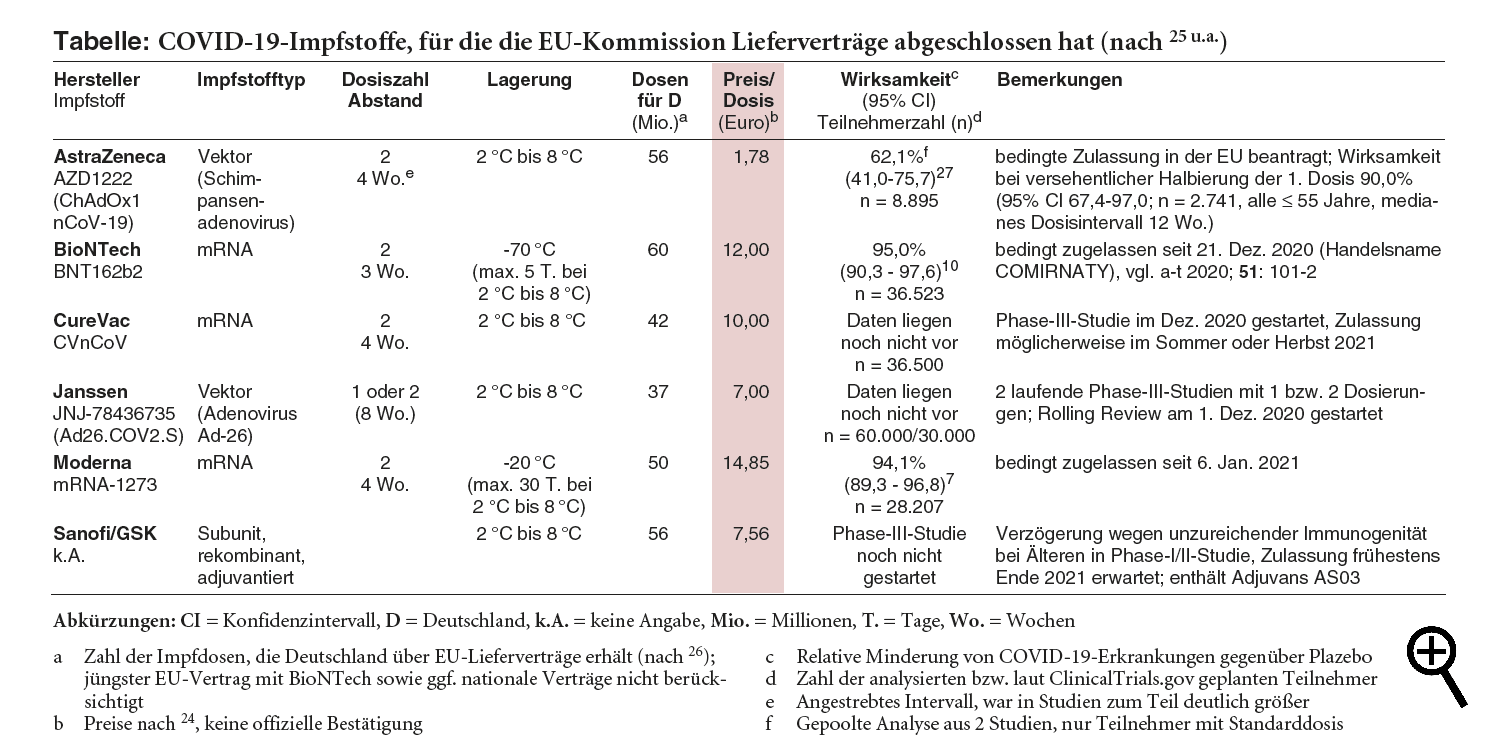
Anfang Januar hat ein zweiter Impfstoff gegen SARS-CoV-2 in der EU eine bedingte Zulassung erhalten, mRNA-1273 der US-amerikanischen Firma Moderna. In den USA und Kanada ist er bereits seit dem 18. bzw. 23. Dezember 2020 notfallmäßig zugelassen.1,2 Wie die BioNTech/Pfizer-Vakzine BNT162b2 (COMIRNATY, a-t 2020; 51: 92, 101-2) basiert mRNA-1273 auf Boten (messenger [m])-RNA, muss aber im Gegensatz zu dieser weniger aufwändig gelagert (-20 °C statt -70 °C) und vor der Anwendung nicht verdünnt werden.3 Im ersten Quartal wird Deutschland vom Moderna-Impfstoff mit voraussichtlich 1,8 Millionen Dosen deutlich weniger erhalten als von der BioNTech-Vakzine, von der in diesem Zeitraum – offenbar trotz der angekündigten vorübergehenden Lieferverzögerung4 – gut 10 Millionen Dosen erwartet werden.5 Dabei ist die jüngst erfolgte Genehmigung der europäischen Arzneimittelbehörde EMA, aus den Mehrdosisbehältern eine zusätzliche (sechste) Dosis BNT162b2 zu entnehmen,6 noch nicht berücksichtigt.5
EIGENSCHAFTEN: Wie BNT162b2 enthält mRNA-1273 Genabschnitte von SARS-CoV-2 in Form von modifizierter mRNA, die das Spike-Protein des Virus kodieren und in Lipid-Nanopartikel verkapselt sind. Nach intramuskulärer Injektion werden diese von lokalen Zellen und den drainierenden Lymphknoten aufgenommen und setzen die Erbinformation frei, nach der anschließend für einen kurzen Zeitraum das Virusprotein synthetisiert und dem Immunsystem präsentiert wird. Dies induziert eine zelluläre Immunreaktion und die Bildung neutralisierender Antikörper.3
| Dosierung | 2 Impfdosen zu 100 µg intramuskulär (i.m.) im Abstand von 4 Wochen |
| Lagerung | bei -25 °C bis -15 °C, aufgetaut bis zu 30 Tage bei 2 °C bis 8 °C oder bis zu 12 Stunden bei max. 25 °C haltbar, nach Anbruch muss der Inhalt des Mehrdosisbehälters (10 Impfdosen) innerhalb von 6 Stunden verbraucht werden3 |
WIRKSAMKEIT: Der Nutzen von mRNA-1273 wird in einer noch laufenden randomisierten doppelblinden Phase-III-Studie (COVE)7 geprüft, in der 30.420 Erwachsene aus den USA zwei Dosierungen des mRNA-Impfstoffs oder Plazebo (Kochsalz) im Abstand von 28 Tagen i.m. erhalten. 25% sind mindestens 65 Jahre alt, 4,6% 75 Jahre und älter.3,7-9 18,5% haben mindestens eine (stabile) Vorerkrankung, die das Risiko für einen schweren COVID-19-Verlauf erhöht, wie Diabetes, Übergewicht (BMI ≥ 40 kg/m2) oder chronische Lungen- bzw. kardiale Erkrankungen.7,8 Immunsupprimierte Patienten sind ausgeschlossen, ebenso Personen mit bekannter SARS-CoV-2-Infektion in der Vorgeschichte. Wird zu Studienbeginn jedoch serologisch oder virologisch eine Infektion festgestellt, dürfen sie dennoch teilnehmen (2,2%).7 Die Studienpopulation entspricht weitgehend der in der entsprechenden Untersuchung zur BioNTech/Pfizer-Vakzine.10
Primärer Endpunkt sind Erkrankungen an COVID-19* ab Tag 14 nach der zweiten Dosis bei Personen ohne SARS-CoV-2-Infektion vor der ersten Immunisierung, die zweimal geimpft sind (maximaler Abstand 42 Tage) und keine Protokollverletzungen aufweisen (n = 28.207). Innerhalb eines medianen Nachbeobachtungszeitraums von neun Wochen nach der zweiten Dosis mindert mRNA-1273 die Erkrankungsrate um 94,1% (95% Konfidenzintervall [CI] 89,3-96,8; 11/14.134 versus 185/14.073).3,7-9 Ein protektiver Effekt deutet sich etwa ab Tag 14 nach der ersten Impfung an.7,9
| * | COVID-19-Erkrankung definiert als positiver PCR-Test plus mindestens zwei systemische Symptome (Fieber, Schüttelfrost, Myalgie, Kopfschmerz, Halsschmerzen, neu aufgetretene Geschmacks- oder Geruchsstörung) oder mindestens ein respiratorisches Symptom (Husten, Kurzatmigkeit oder klinischer/radiologischer Nachweis einer Pneumonie).7,8 |
In Subgruppenanalysen wird für Teilnehmer ab 65 Jahre eine etwas geringere Effektivität von 86,4% errechnet (95% CI 61,4-95,2; 4 vs. 29 Erkrankungen).3,7-9 Ob der Moderna-Impfstoff in dieser Altersgruppe möglicherweise schwächer wirksam ist als die BioNTech-Vakzine (Schutzrate 94,7%; 1 vs. 19),10 bleibt angesichts der kleinen Ereigniszahlen und des indirekten Vergleichs offen. Bei Patienten ab 75 Jahre treten – ähnlich wie bei BNT162b2 – nur sehr wenige Ereignisse auf (0 vs. 7 symptomatische SARS-CoV-2-Infektionen).3,7 Liegen Begleiterkrankungen vor, beträgt die Schutzrate von mRNA-1273 90,9% (95% CI 74,7-96,4; 4 vs. 43).7
Schwere COVID-19-Erkrankungen,** einer der sekundären Endpunkte, werden im analysierten Beobachtungszeitraum bei keinem der Geimpften beobachtet gegenüber 30 Patienten unter Plazebo. 19 Betroffene werden stationär behandelt, darunter zwei auf der Intensivstation. Ein Patient stirbt.3,7,9 Bei der Mehrzahl der Patienten wird die Erkrankung allerdings lediglich aufgrund einer Sauerstoffsättigung ≤ 93% als schwer eingestuft.3,9 Nach Abschluss der Analysen wird eine bereits im Beobachtungszeitraum aufgetretene schwere COVID-19-Erkrankung in der Impfgruppe bestätigt.9 Details werden nicht mitgeteilt.
| ** | Schwere COVID-19-Erkankung erfüllt die Definition einer COVID-19-Erkrankung plus mindestens eines der folgenden Kriterien: klinische Zeichen in Ruhe, die auf eine schwere systemische Erkrankung hinweisen (Atemfrequenz ≥ 30/min, Herzfrequenz ≥ 125/min, Sauerstoffsättigung ≤ 93% u.a.); respiratorisches Versagen oder akutes Atemnotsyndrom (definiert als Bedarf an High-flow-Sauerstoff, nichtinvasiver oder mechanischer Beatmung oder ECMO); Hinweise auf einen Schock; signifikante akute renale, hepatische oder neurologische Dysfunktion; Verlegung auf die Intensivstation oder Tod.16 |
Unklar ist, ob 50 µg mRNA-1273, also die Hälfte der zugelassenen Dosierung, möglicherweise ausreichen: In einer laufenden randomisierten „Dosis-Bestätigungs-Studie“ schneiden 50 µg und 100 µg hinsichtlich der Induktion bindender bzw. neutralisierender Antikörper ähnlich ab.9 Klinische Daten finden wir dazu nicht.
Für eine Beurteilung des Schutzeffekts nach nur einer Dosis reichen die Daten nach Einschätzung der FDA weder bei der Moderna- noch bei der BioNTech-Vakzine aus.9,11 Überlegungen, wegen der Knappheit der SARS-CoV-2-Impfstoffe die zweite Dosis aufzuschieben, wie beispielsweise in Großbritannien empfohlen,12 haben sowohl die US-amerikanische Behörde13 als auch die EMA14 und die Ständige Impfkommission15 eine Absage erteilt. Auch wir halten es für richtig, dass der in den Studien der beiden mRNA-Vakzinen geprüfte maximale Abstand von sechs Wochen nicht überschritten wird, da unter anderem derzeit offen ist, ob durch eine höhere Zahl einmal Geimpfter mehr schwere Erkrankungen verhindert werden als durch zeitnahe zweite Immunisierung der vulnerablen Hochrisikogruppen.15
Insgesamt scheint mRNA-1273 ähnlich wirksam zu sein wie BNT162b2, bei ebenso kurzer Nachbeobachtungszeit. Daten zur Anwendung bei Schwangeren und Immunsupprimierten liegen für keinen der beiden Impfstoffe vor. Auch bei Kindern und Jugendlichen ist die Moderna-Vakzine bislang nicht untersucht, die – anders als der BioNTech-Impfstoff, der ab einem Alter von 16 Jahren zugelassen ist17 – nur bei Erwachsenen angewendet werden darf.3 Für beide Impfstoffe bleibt zudem derzeit offen, ob asymptomatische Infektionen verhindert werden*** und wie lange der Schutz anhält.
| *** | Die Verhinderung asymptomatischer Infektionen wird als sekundärer Endpunkt auf Basis von Serokonversionsraten bzw. – bei eingangs Seropositiven – Antikörpertiter-Anstiegen geprüft,16 Ergebnisse liegen noch nicht vor. |
SICHERHEIT: Bei allen Teilnehmern werden mithilfe eines elektronischen Tagebuchs nach jeder Dosis sieben Tage lang typische lokale und systemische Impfreaktionen ermittelt. mRNA-1273 erweist sich dabei als ähnlich stark reaktogen wie die BioNTech-Vakzine: Lokalreaktionen treten nach der ersten Dosis bei 84,2% auf und nach der zweiten Dosis bei 88,6% (Plazebo: 19,8% bzw. 18,8%), halten im Median zwei bis drei Tage an und werden nach der zweiten Dosis häufiger als schwer****eingestuft (3,5% bzw. 7% vs. jeweils 0,5% unter Plazebo).7-9 Mit Abstand am häufigsten wird über Schmerz an der Injektionsstelle berichtet (bis 88,2%), gefolgt von Schwellung oder Druckempfindlichkeit regionaler Lymphknoten (bis 14,2%).7 Patienten unter 65 Jahre sind häufiger betroffen als ältere (z.B. Schmerz nach Dosis 1: 87% vs. 74%).7,8
| **** | Schwere Intensität: Definition variiert je nach unerwünschtem Ereignis, bedeutet in der Regel aber, dass Alltagsaktivitäten nicht möglich sind.16 |
Systemische Impfreaktionen kommen nach der ersten Dosis bei 54,9% vor und nach der zweiten bei 79,4% (Plazebo: 42,2% bzw. 36,5%).7 Sie setzen meist am Tag der Immunisierung oder einen Tag danach ein und halten im Median zwei Tage an.9 Nach der zweiten Dosis treten sie nicht nur häufiger auf, sondern werden auch häufiger als schwer eingestuft (bis 10,7%). Berichtet werden unter anderem Müdigkeit (Dosis 2, < 65 Jahre: 67,6%, ≥ 65 Jahre: 58,3%), Kopfschmerz (62,8% bzw. 46,2%), Myalgie (61,6% bzw. 47,1%), Gelenkschmerz (45,5% bzw. 35%), Übelkeit/Erbrechen (21,4% bzw. 11,8%) und Fieber (17,4% bzw. 10%).7,8 57% der unter 65-Jährigen wenden nach der zweiten Dosis ein Analgetikum oder Antipyretikum an (≥ 65 Jahre: 42%).8 Auch wenn derartige üblicherweise selbstlimitierende unerwünschte Impfreaktionen mehrheitlich mild verlaufen, können nach einer aktuellen Mitteilung der norwegischen Arzneimittelbehörde18,19 anlässlich mehrerer Todesfälle bei Pflegeheimbewohnern in zeitlichem Zusammenhang mit der Immunisierung gegen SARS-CoV-2 bei sehr alten gebrechlichen Patienten mit schwerwiegenden Vorerkrankungen ernsthafte Konsequenzen nicht ausgeschlossen werden (siehe Kasten).
Wie bei BNT162b2 werden Ereignisse, die mit Überempfindlichkeit in Zusammenhang stehen, unter mRNA-1273 numerisch häufiger berichtet als unter Plazebo (1,5% vs. 1,1%), darunter Hautausschlag und Urtikaria an der Injektionsstelle sowie makulopapulöses Exanthem.7,9 Anaphylaktische oder schwere Überempfindlichkeitsreaktionen in engem zeitlichen Zusammenhang mit der Impfung sollen laut FDA nicht aufgetreten sein.9 Auch unter dem Moderna-Impfstoff wurde aber – ebenfalls wie bei der BioNTech-Vakzine – unmittelbar nach Beginn der breiten Anwendung in den USA ein Bericht über Anaphylaxie bekannt. Für BNT162b2 schätzt die US-amerikanische CDC das Risiko einer Anaphylaxie derzeit auf etwa 1: 100.000 (siehe Seite 7).22 Entsprechende Analysen für die Moderna-Vakzine liegen noch nicht vor. Bei beiden Impfstoffen sollen die Patienten nach jeder Immunisierung mindestens 15 Minuten lang engmaschig überwacht werden, eine zur Behandlung anaphylaktischer Reaktionen geeignete Ausrüstung sollte immer bereitstehen. Bei bekannter Überempfindlichkeit gegen einen der Inhaltstoffe sind beide Vakzinen kontraindiziert.3,17
In der Phase-III-Studie treten unter mRNA-1273 zudem bei zwei Frauen ein bzw. zwei Tage nach Impfung Schwellungen im Gesichtsbereich auf, die als schwerwiegend eingestuft werden. Bei einer dritten Frau wird ein Angioödem der Lippen zwei Tage nach Immunisierung berichtet. Alle drei hatten zuvor aus kosmetischen Gründen Injektionen dermaler Füllsubstanzen erhalten. Die FDA hält eine entzündliche Reaktion als Folge einer Interaktion zwischen der Immunantwort auf den Impfstoff und dem Füllmaterial für möglich.9
Auffällig sind auch 3 Berichte über Fazialisparese unter dem Moderna-Impfstoff (Plazebo: 1), die sich bei zwei Betroffenen im Nachbeobachtungszeitraum gebessert oder zurückgebildet hat.3,7,9 Unter der BioNTech-Vakzine wurden Fazialisparesen ebenfalls numerisch häufiger berichtet als unter Scheinmedikament (4 vs. 0), was den Verdacht auf einen Zusammenhang mit der Impfung stützt.7
KOSTEN: Zu welchen Konditionen die COVID-19-Impfstoffe erworben werden, ist nicht offiziell kommuniziert worden. Inoffiziell wird als Preis für eine Dosis des Moderna-Impfstoffs mRNA-1273 20 € genannt und damit rund ein Drittel mehr als für die BioNTech-Vakzine BNT162b2 (15 €/ Dosis).23 Nach einer im Dezember kurzzeitig von einer belgischen Politikerin auf Twitter verbreiteten Tabelle sollen die Kosten bei etwa 15 € bzw. 12 € pro Dosis liegen.24 Bei Entnahme einer zusätzlichen Dosis verringert sich der Preis einer BioNTech-Impfdosis um 17%.
Seit Anfang Januar ist der COVID-19-Impfstoff von Moderna (mRNA-1273) als zweiter Impfstoff zur Prävention symptomatischer SARS-CoV-2-Infektionen in der EU bedingt zugelassen. Wie die BioNTech-Vakzine BNT162b2 (COMIRNATY) basiert er auf Boten (messenger [m])-RNA.
Der Moderna-Impfstoff mindert in einer großen randomisierten Studie die Zahl der COVID-19-Erkrankungen nach zweimaliger Immunisierung im Abstand von vier Wochen um 94%. Bei Teilnehmern ab 65 Jahre beträgt die Schutzrate 86%. Ob mRNA-1273 in dieser Altersgruppe tatsächlich einen schwächeren Effekt hat als bei Jüngeren und ob die BioNTech-Vakzine hier möglicherweise besser wirksam ist, lässt sich aufgrund der wenigen Ereignisse und des indirekten Vergleichs nicht beurteilen.
Schwere COVID-19-Erkrankungen werden im analysierten Zeitraum nur in der Plazebogruppe berichtet (30 vs. 0 Erkrankungen). Nach Abschluss der Analyse wird jedoch eine bereits im Beobachtungszeitraum aufgetretene schwere Erkrankung in der Impfgruppe bestätigt.
Mit Lokalreaktionen, insbesondere Schmerz an der Injektionsstelle, ist bei bis zu 90% der Geimpften zu rechnen. Systemische Reaktionen wie Müdigkeit, Kopfschmerz, Myalgie und Fieber kommen bei bis zu 80% vor, sind nach der zweiten Dosis häufiger und werden dann auch häufiger als schwer eingestuft (bis 11%). Personen unter 65 Jahre sind von den Impfreaktionen häufiger betroffen als ältere.
Numerisch häufiger als unter Scheinmedikament werden – wie bei BNT162b2 – Überempfindlichkeitsreaktionen und Fazialisparesen beobachtet. Auch unter dem Moderna-Impfstoff ist nach Markteinführung in den USA ein Bericht über Anaphylaxie bekannt geworden.
Bei mRNA-1273 ist die Nachbeobachtungszeit mit im Median neun Wochen bislang ebenfalls sehr kurz, sodass auch hier viele Fragen offen bleiben – beispielsweise zur Dauer des Schutzes, dem Effekt auf asymptomatische Infektionen und Ansteckungsfähigkeit und zu potenziellen bislang unbekannten schwerwiegenden Risiken.
Insgesamt scheinen die beiden mRNA-Impfstoffe beim derzeitigen Kenntnisstand ähnlich wirksam zu sein, und auch bei der Verträglichkeit fallen keine wesentlichen Unterschiede auf. Der Impfstoff von Moderna bietet Vorteile hinsichtlich Lagerung und Handhabung. Unseres Erachtens kommen beide nach entsprechender Aufklärung für die Immunisierung gegen SARS-CoV-2 in Betracht, die wir trotz der offenen Fragen in der aktuellen Situation ausdrücklich befürworten.
TODESFÄLLE IN ZEITLICHEM ZUSAMMENHANG MIT DEM BIONTECH-IMPFSTOFF
Die norwegische Arzneimittelbehörde dokumentiert laut einer aktuellen Mitteilung 23 Verdachtsberichte über Tod im zeitlichen Zusammenhang mit dem COVID-19-Impfstoff BNT162b2 von BioNTech/Pfizer.18,19 In Norwegen werden bislang ausschließlich Bewohner von Pflegeheimen und anderen Einrichtungen der Langzeitbetreuung geimpft, von denen viele sehr gebrechlich sind und die meist schwerwiegende Vorerkrankungen haben. Die Sterblichkeit in dieser Personengruppe ist mit durchschnittlich 45 pro Tag entsprechend hoch, und Todesfälle in zeitlichem Zusammenhang mit der Impfung sind daher zu erwarten. Viele Melder vermuten gar keinen Zusammenhang mit der Immunisierung, sondern sehen die Grunderkrankung als ursächlich an und berichten den Todesfall lediglich „um der Vollständigkeit willen“.19 Die Behörde kann jedoch nicht ausschließen, dass bei einigen der gebrechlichsten Patienten möglicherweise selbst relativ milde unerwünschte Effekte schwerwiegende Konsequenzen haben könnten. Ob, und wenn ja, welche unerwünschten Impfreaktionen bei den Verstorbenen zuvor aufgetreten sind, ist der Auswertung – analysiert wurden bislang 13 der 23 Meldungen zu Todesfällen – allerdings nicht zu entnehmen.19 Die norwegischen Behörden erinnern aber zu Recht daran, dass bei sehr gebrechlichen Patienten oder unheilbar Kranken mit kurzer Lebenserwartung der Nutzen der Impfung sehr gering sein kann und daher sorgfältig gegen das Risiko auch milder potenzieller unerwünschter Effekte abgewogen werden muss.20
In Deutschland liegen dem Paul-Ehrlich-Institut (PEI) 10 Verdachtsberichte über Tod in zeitlichem Zusammenhang mit der COVID-19-Impfung vor (Stand 14. Januar 2021, verwendete Vakzine dürfte demnach ebenfalls BNT162b2 gewesen sein, –Red.). Es soll sich um Patienten mit „gravierenden Grunderkrankungen“ gehandelt haben, die nach derzeitiger Einschätzung des PEI ursächlich für den Tod gewesen sein sollen.21
| (R = randomisierte Studie) | ||
| 1 | FDA: Pressemitteilung vom 18. Dez. 2020; http://www.a-turl.de/?k=angk | |
| 2 | Health Canada: Pressemitteilung vom 23. Dez. 2020; http://www.a-turl.de/?k=rinz | |
| 3 | EMA/Moderna: SPC COVID-19 VACCINE MODERNA, Stand 6. Jan. 2021; http://www.a-turl.de/?k=esho | |
| 4 | Dt. Ärztebl. vom 15. Jan. 2021; http://www.a-turl.de/?k=ermu | |
| 5 | SPAHN, J. (BMG): Schreiben an die Mitglieder des Deutschen Bundestages vom 11. Jan. 2021 | |
| 6 | EMA: Pressemitteilung vom 8. Jan. 2021; http://www.a-turl.de/?k=utta | |
| R | 7 | BADEN, L.R. et al.: N. Engl. J. Med., online pub. am 30. Dez. 2020; https://doi.org/10.1056/NEJMoa2035389 (14 Seiten) |
| 8 | FDA: Fact Sheet mRNA-1273, Stand Dez. 2020; http://www.a-turl.de/?k=allh | |
| 9 | FDA: Review mRNA-1273, 18. Dez. 2020; http://www.a-turl.de/?k=ardt | |
| R | 10 | POLACK, F.P. et al.: N. Engl. J. Med. 2020; 383: 2603-15 |
| 11 | FDA: Review BNT162b2, 11. Dez. 2020; http://www.a-turl.de/?k=aarw | |
| 12 | Department of Health and Social Care (UK): Pressemitteilung vom 30. Dez. 2020; http://www.a-turl.de/?k=erre | |
| 13 | FDA: Pressemitteilung vom 4. Jan. 2021; http://www.a-turl.de/?k=utzl | |
| 14 | Dt. Ärztebl. vom 4. Jan. 2021; http://www.a-turl.de/?k=arkv | |
| 15 | STIKO: Epidemiol. Bull. 2021; Nr. 2: 3-71; http://www.a-turl.de/?k=upbu | |
| 16 | Moderna: Studienprotokoll, Stand Nov. 2020; http://www.a-turl.de/?k=reek | |
| 17 | EMA/BioNTech: SPC COMIRNATY, Stand 8. Jan. 2021; http://www.a-turl.de/?k=erzw | |
| 18 | Norwegian Medicines Agency: Mitteilung vom 15. Jan. 2021; Stand 19. Jan. 2021; http://www.a-turl.de/?k=ried | |
| 19 | Norwegian Medicines Agency: Wöchentlicher Bericht über Verdachtsberichte unerwünschter Reaktionen auf Coronavirus-Impfstoffe, Stand 14. Jan. 2021; http://www.a-turl.de/?k=chon | |
| 20 | Norwegian Institute of Public Health: Informationen für Patienten, Stand 18. Jan. 2021; http://www.a-turl.de/?k=elke | |
| 21 | Dt. Ärztebl. vom 18. Jan. 2021; http://www.a-turl.de/?k=nspe | |
| 22 | CDC COVID-19 Response Team, FDA: MMWR 2021; 70: 46-51 | |
| 23 | LIESE, P.: Schreiben vom 27. Nov. 2020 | |
| 24 | BOSSAERT, J.: HLN News vom 17. Dez. 2020; http://www.a-turl.de/?k=urka | |
| 25 | WHO: The COVID-19 candidate vaccine landscape, Stand 15. Jan. 2021; http://www.a-turl.de/?k=anau | |
| 26 | BMG: Informationen zum Impfen/Zugangs- und Verteilungsfragen, Stand 7. Jan. 2021; http://www.a-turl.de/?k=rive | |
| R | 27 | VOYSEY, M. et al.: Lancet 2021; 397: 99-111 |
© 2021 arznei-telegramm, publiziert am 22. Januar 2021
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
