SIMEPREVIR (OLYSIO) GEGEN CHRONISCHE HEPATITIS C
Mit Simeprevir (OLYSIO) ist der dritte Proteasehemmer zur Behandlung Erwachsener mit chronischer Hepatitis C im Handel.1 Janssen-Cilag kündigt ihn als "neue Ära in der Hepatitis-C-Therapie" an.2 Die beiden älteren Proteasehemmer Boceprevir (VICTRELIS; a-t 2011; 42; 77-9) und Telaprevir (INCIVO; a-t 2011; 42: 104-7) werden von Fachgesellschaften in Europa und den USA inzwischen nicht mehr3,4 oder nur noch als letzte Reserve empfohlen,5 seitdem der möglicherweise wirksamere und zugleich verträglichere Polymerasehemmer Sofosbuvir (SOVALDI; e-a-t 4/2014 und a-t 2014; 45: 33-4) verfügbar ist. Anders als Sofosbuvir, das bei den Genotypen 1 bis 6 zugelassen ist, darf Simeprevir nur beim hierzulande häufigsten Genotyp 1 sowie dem selteneren Typ 4 angewendet werden. Primär soll es mit Peginterferon alfa (2a: PEGASYS, 2b: PEGINTRON) plus Ribavirin (COPEGUS, REBETOL, Generika) kombiniert werden, genauso wie Sofosbuvir bei diesen Genotypen. Nach zwölfwöchiger Dreifachkombination müssen Simeprevir-Behandelte jedoch - im Gegensatz zu Sofosbuvir - weitere zwölf Wochen Peginterferon alfa und Ribavirin erhalten, vorherige Non-Responder sogar weitere 36 Wochen. Als interferonfreie Therapie ist die Kombination von Simeprevir plus Sofosbuvir mit oder ohne Ribavirin für 12 Wochen - wie Sofosbuvir plus Ribavirin bei diesen Genotypen - nur erlaubt, wenn eine Behandlung dringend* ist und gleichzeitig Interferone nicht angewendet werden können.1
| * | Wann "eine Behandlung dringend ist", wird in der Fachinformation1 nicht erläutert. Im Rahmen der Anwendung der noch nicht zugelassenen Kombination aus Sofosbuvir und Ledipasvir wurde von der europäischen Arzneimittelbehörde EMA beispielsweise ein hohes Risiko für Dekompensation oder Tod innerhalb von zwölf Monaten ohne Therapie als Definition akzeptiert.8 |
EIGENSCHAFTEN: Wie Boceprevir und Telaprevir hemmt Simeprevir die virale NS3/4A**-Protease.6 Gegenüber Boceprevir und Telaprevir muss mit Kreuzresistenz gerechnet werden.1
** NS3/4A-Protease = nicht strukturelle 3/4A-Protease
| Tagesdosis | 1 x tgl. 150 mg zusammen mit Nahrung |
| Bioverfügbarkeit | 62% bei Einnahme nach Nahrungsaufnahme |
| Verstoffwechselung | vor allem über CYP3A4 in der Leber |
| Ausscheidung | zu 91% in den Fäzes |
| Wechselwirkungen | zahlreiche, vor allem über CYP3A4 und Arzneimitteltransporter wie P-Glykoprotein1 |
WIRKSAMKEIT: Studien zum Vergleich mit Sofosbuvir sowie mit Boceprevir und Telaprevir fehlen. Ähnlich wie in den Zulassungsstudien von Sofosbuvir wird in den Phase-III-Studien auf anhaltendes virologisches Ansprechen bereits 12 statt - wie in früheren Studien - 24 Wochen nach geplantem Therapieende geprüft. Bei Erwachsenen mit chronischer Hepatitis C Genotyp 1 ohne Vortherapie oder mit Rückfall nach interferonbasierter proteasehemmerfreier Therapie steigert der Zusatz von Simeprevir zum früheren Standard aus Peginterferon alfa plus Ribavirin die Rate des virologischen Ansprechens von etwa 40% bis 50% auf 80% (siehe Tabelle).6*** Auch vorherige Nonresponder scheinen deutlich häufiger virusfrei zu werden, untersucht ist dies allerdings nur in der Subgruppe einer Phase-IIb-Studie.6,7 Zur Anwendung der Dreifachkombination bei Genotyp 4, bei Koinfektion mit HIV und für die Kombination mit Sofosbuvir mit oder ohne Ribavirin bei Genotyp 1 oder 4 fehlt ein Vergleich mit Standard- oder anderen Regimen (siehe Tabelle).6
| *** | Zusatz von Boceprevir oder Telaprevir zu Peginterferon alfa plus Ribavirin steigert die Ansprechraten bei nicht Vorbehandelten und bei Vorbehandelten im indirekten Vergleich ähnlich wie Simeprevir. In den entsprechenden Studien werden zwar niedrigere Ansprechraten erreicht als unter Simeprevir, aber auch in den Kontrollarmen sind niedrigere Raten als in den Simeprevir-Studien beschrieben. |

Zum Vergleich: Sofosbuvir erreicht bei Genotyp 1 in nur zwölfwöchiger Kombination mit Peginterferon alfa und Ribavirin bei nicht vorbehandelten Patienten eine Ansprechrate von 90%, dies allerdings in einer nicht kontrollierten Phase-III-Studie.13 Für vorbehandelte Patienten mit Genotyp 1 liegen zu Sofosbuvir nur in der derzeit noch nicht zugelassenen Fixkombination mit dem NS5A-Inhibitor Ledipasvir (noch nicht im Handel****) Daten aus einer Phase-III-Studie vor.14
**** Im Rahmen eines Härtefallprogramms (compassionate use) erhältlich.8
Vor der Anwendung von Simeprevir zusammen mit Peginterferon alfa plus Ribavirin bei Genotyp 1a wird dringend der Test auf NS3-Q80K-Polymorphismus***** empfohlen.1 Liegt diese Genvariante vor, ist die Wirksamkeit nur marginal6 und eine Alternativbehandlung zu erwägen. Sie wird bei 19% der Studienteilnehmer aus Europa mit Hepatitis-C-Virus Genotyp 1a nachgewiesen (bei Genotyp 1b in 0,3%). Auch bei Kombination mit Sofosbuvir soll der Test in Betracht gezogen werden.1
| ***** | NS3-Q80K-Polymorphismus = Austausch der Aminosäure Glutamin gegen Lysin an Position 80 der Aminosäurekette der NS3-Protease |
STÖRWIRKUNGEN: Durch Zusatz von Simeprevir zu Peginterferon alfa plus Ribavirin kommt es - ähnlich wie unter Telaprevir - häufiger zu Hautausschlag (innerhalb der ersten zwölf Wochen: 25% versus 19% unter Plazebo jeweils mit Peginterferon alfa plus Ribavirin, schwer: 0,5% vs. 0%, Fotosensitivitätsreaktionen nicht mitgerechnet) und Pruritus (22% vs. 15%). Lebensbedrohliche und tödliche Hautreaktionen sind - anders als unter Telaprevir (a-t 2013; 44: 15-6) - bislang nicht beschrieben. Erythema multiforme, das schwer verlaufen kann, sich im Allgemeinen jedoch ohne FolgeFolgeschäden zurückbildet, wurde bei einem Patienten berichtet und trat in der Majorform nach Einschätzung der FDA möglicherweise bei vier weiteren Patienten auf. Fotosensitivitätsreaktionen sind trotz des empfohlenen Sonnenschutzes häufiger (5% vs. 1%)15 und erfordern bei 0,3% der mit Simeprevir Behandelten eine stationäre Therapie. Während der Behandlung mit Simeprevir ist daher geeigneter Sonnenschutz nötig, intensive und längere Sonnenlicht- sowie Solarienexposition sind zu vermeiden.1
Erhöhte Bilirubinwerte kommen häufig vor (8% vs. 3%), über dem 2,5-Fachen der oberen Normgrenze in 2% vs. 0,3%.1 Als Ursache wird die Hemmung von Transportern in der Leber vermutet. Geringe bis moderate Atemnot tritt ebenfalls öfter auf (12% vs. 8%), insbesondere bei Patienten über 45 Jahre (16% vs. 9%). Die Ursache hierfür ist unklar.6 Anämie ist zwar wie unter Boceprevir und Telaprevir sehr häufig. Simeprevir steigert die Anämierate gegenüber der Zweifachkombination plus Plazebo jedoch nur gering (13% vs. 11%). Schwere Neutropenie (11% vs. 10%) und schwere Thrombozytopenie (2% vs. 1%) werden ebenfalls tendenziell häufiger beobachtet.15
Schwere (23% vs. 25%) und schwerwiegende (2% vs. 2,5%) unerwünschte Ereignisse insgesamt sowie solche, die zum Absetzen eines der Arzneimittel führen (2,6% vs. 4,5%), nehmen unter Simeprevir nicht zu,6 schwere unerwünschte Ereignisse, bei denen ein Zusammenhang mit der Therapie vermutet wird, hingegen schon (3,1% vs. 0,5%).1 Ein indirekter Vergleich mit Sofosbuvir ist kaum möglich: In den Zulassungsstudien von Sofosbuvir wurden keine spezifischen Störwirkungen festgestellt, was jedoch an den weitgehend fehlenden Kontrollgruppen gelegen haben kann.
RESISTENZ: Neu aufgetretene und zum Teil persistierende Aminosäuresubstitutionen in der viralen NS3-Protease, die in vitro die Aktivität von Simeprevir reduzieren, wurden in den kontrollierten Phase-IIb/III-Studien bei 91% der Patienten ohne anhaltendes virologisches Ansprechen auf die Dreifachkombination gefunden. Die langfristigen klinischen Auswirkungen sind unklar.1
EMPFEHLUNGEN: Die Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) empfiehlt Simeprevir bei Genotyp 1 ausschließlich bei Interferon-Unverträglichkeit bzw. Kontraindikation, also nur als extrem teure Kombination mit Sofosbuvir mit oder ohne Ribavirin,3 während europäische und US-amerikanische Fachgesellschaften bei Patienten, die Interferone erhalten können, Simeprevir plus Peginterferon alfa und Ribavirin als Alternative zu Sofosbuvir plus Peginterferon alfa und Ribavirin befürworten.4,5
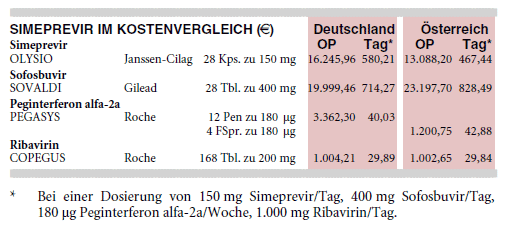
KOSTEN: 1 x tgl. 150 mg Simeprevir (OLYSIO) für 12 Wochen kosten fast 49.000 €. In Kombination mit Peginterferon alfa-2a (PEGASYS) und Ribavirin (COPEGUS) für 24 Wochen kostet die Hepatitis-C-Therapie 8% weniger als mit Sofosbuvir (SOVALDI) plus Peginterferon alfa-2a und Ribavirin für 12 Wochen (60.484 € versus 65.871 € - berechnet für täglich 1.000 mg Ribavirin und 150 mg Simeprevir bzw. 400 mg Sofosbuvir und wöchentlich 180 µg Peginterferon alfa-2a). Die von der DGVS empfohlene Kombination mit Sofosbuvir für zwölf Wochen bei Interferonunverträglichkeit kostet 108.736 €, wenn auf Ribavirin verzichtet wird.
Mit Simeprevir (OLYSIO) ist nach Boceprevir (VICTRELIS) und Telaprevir (INCIVO) der dritte Proteasehemmer zur Therapie der chronischen Hepatitis C bei Erwachsenen im Handel.
Zusatz von Simeprevir zu Peginterferon alfa (2a: PEGASYS, 2b: PEGINTRON) plus Ribavirin (COPEGUS, REBETOL, Generika) steigert die Rate des virologischen Ansprechens bei Genotyp 1 im indirekten Vergleich ähnlich wie deren Kombination mit Boceprevir oder Telaprevir, aber möglicherweise weniger als der Zusatz des Polymerasehemmers Sofosbuvir (SOVALDI). Direkte Vergleiche fehlen. Bei Patienten mit Rückfall ist Simeprevir besser geprüft als Sofosbuvir. Wegen Wirkverlusts soll insbesondere bei Genotyp 1a vor Therapiebeginn auf NS3-Q80K-Polymorphismus getestet werden.
Wie bei Telaprevir, unter dem tödliche Hautreaktionen bekannt sind, werden Hautausschlag und Pruritus unter Simeprevir sehr häufig beobachtet. Auch schwere Hautreaktionen kommen vor. Sonnenschutz ist erforderlich, da Fotosensitivitätsreaktionen häufig sind. Anders als bei Boceprevir und Telaprevir kommen schwerwiegende unerwünschte Ereignisse insgesamt nicht häufiger und Anämie nur etwas häufiger vor als unter Peginterferon alfa plus Ribavirin allein. Sofosbuvir wird möglicherweise besser vertragen als Simeprevir.
Wir halten die Behandlung mit Simeprevir in Kombination mit Peginterferon alfa plus Ribavirin noch am ehesten bei Patienten mit Genotyp 1 und mit Rückfall nach einer interferonbasierten proteasehemmerfreien Therapie, aber ohne NS3-Q80K-Polymorphismus für vertretbar.
| (R = randomisierte Studie) | |
| 1 | Janssen-Cilag: Fachinformation OLYSIO, Stand Juni 2014 |
| 2 | Janssen-Cilag: Zulassung von OLYSIO(Simeprevir). Neue Ära in der Hepatitis C-Therapie, Mai 2014 http://www.a-turl.de/?k=etti (Anmeldung erforderlich) |
| 3 | DGVS, bng: Aktuelle Empfehlung der DGVS und des bng zur Therapie der chronischen Hepatitis C, ohne Datum, Zugriff Aug. 2014 http://www.a-turl.de/?k=resd |
| 4 | AASLD, IDSA: Recommendations for Testing, Managing, and Treating Hepatitis C, Aug. 2014; http://www.a-turl.de/?k=eiff |
| 5 | EASL: EASL Recommendations on Treatment of Hepatitis C 2014; April 2014; http://www.a-turl.de/?k=astd |
| 6 | EMA: Europ. Beurteilungsbericht (EPAR) OLYSIO, Stand März 2014; http://www.a-turl.de/?k=nzin |
| R 7 | ZEUZEM, S. et al.: Gastroenterology 2014; 146: 430-41 |
| 8 | EMA: Summary on compassionate use for Ledipasvir/Sofosbuvir, Febr. 2014; http://www.a-turl.de/?k=ilth |
| R 9 | JACOBSON, I.M. et al.: Lancet 2014; 384: 403-13 |
| R 10 | MANNS, M. et al.: Lancet 2014; 384: 414-26 |
| R 11 | FORNS, X. et al.: Gastroenterology 2014; 146: 1669-79 |
| R 12 | LAWITZ, E. et al.: Lancet, online publ. Juli 2014 (10 Seiten) doi: 10.1016/S0140-6736(14)61036-9 |
| 13 | Gilead: Fachinformation SOVALDI, Stand Apr. 2014 |
| R 14 | AFDHAL, N. et al.: N. Eng. J. Med. 2014; 370: 1483-93 |
| 15 | FDA: Medical Review(s) Simeprevir, Aug. 2013 http://www.a-turl.de/?k=usec |
© 2014 arznei-telegramm, publiziert am 22. August 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
