DABIGATRAN (PRADAXA) BEI NICHTVALVULÄREM VORHOFFLIMMERN
Dabigatran (PRADAXA) ist seit 2008 zur perioperativen Prophylaxe von Thromboembolien nach Hüft- und Kniegelenksersatz zugelassen (a-t 2008; 39: 55-7). Seit September 2011 steht der oral anzuwendende Thrombinhemmer in Tagesdosierungen von zweimal 150 mg und zweimal 110 mg auch zur Prävention von Schlaganfällen und systemischen Embolien bei Patienten mit nichtvalvulärem Vorhofflimmern zur Verfügung, die mindestens einen Risikofaktor aufweisen wie frühere zerebrale Ischämie oder systemische Embolie, linksventrikuläre Auswurffraktion unter 40%, symptomatische Herzinsuffizienz, Alter mindestens 75 Jahre oder mindestens 65 Jahre plus Diabetes mellitus, koronare Herzkrankheit oder arterielle Hypertonie. Laborkontrollen mit Dosisanpassungen wie bei Cumarinen sind routinemäßig nicht erforderlich, aber auch nicht verfügbar.1,2
RE-LY-STUDIE: Die Erweiterung der Zulassung geht auf die dreiarmige randomisierte RE-LY*-Studie zurück, die die beiden Dabigatrandosierungen bei Patienten mit aktuell oder in den sechs Monaten zuvor dokumentiertem Vorhofflimmern und mindestens einem der genannten Risikofaktoren über 12 bis 36 Monate mit Warfarin (COUMADIN) in adjustierter Dosis (INR 2-3) vergleicht. Relevante Herzklappenerkrankung, Schlaganfall vor weniger als zwei Wochen bzw. schwerer Schlaganfall vor weniger als sechs Monaten, erhöhtes Blutungsrisiko und schwerere Einschränkung der Nierenfunktion (Kreatinin-Clearance unter 30 ml/min) sind Ausschlussgrund. Dabigatran wird unverblindet mit Warfarin verglichen, die Dabigatrandosierungen sind dagegen weder Patienten noch Behandelnden bekannt.2,3
| * | RE-LY = Randomized Evaluation of Long Term Anticoagulation TherapY |
Primäres kombiniertes Zielkriterium ist das Auftreten von Schlaganfällen oder systemischen Embolien. Beide Einzelkomponenten separat sowie Todesfälle stellen sekundäre Endpunkte dar, Herzinfarkte, Lungenembolien, transitorische ischämische Attacken und Hospitalisationen weitere prädefinierte Endpunkte. Primäres Sicherheitskriterium sind schwere ("major") Blutungen, definiert als Hämoglobinabfall um mindestens 2 g/dl, Transfusionsbedarf von mindestens zwei Einheiten oder symptomatische kritische Organblutungen. Die primären und sekundären Endpunkte werden von zwei unabhängigen und verblindeten Untersuchern bewertet. Getestet wird unter Adjustierung für multiples Testen auf Nichtunterlegenheit einer der beiden Dabigatrandosierungen gegenüber Warfarin. Bei Nachweis der Nichtunterlegenheit wird auch auf Überlegenheit geprüft.2,3
18.133 Patienten im mittleren Alter von 71 Jahren nehmen teil. 64% sind Männer, 35% leiden an permanentem Vorhofflimmern, 68% weisen einen CHADS**2-Score von 2 oder größer auf. 50% sind mit oralen Antikoagulanzien und 40% mit Azetylsalizylsäure (ASS; ASPIRIN, Generika) vorbehandelt. Die Patienten werden im Median zwei Jahre und bis auf 20 alle bis zum Studienende nachbeobachtet. Unter Dabigatran brechen 21% und unter Warfarin 17% die Studienmedikation ab.2,3
| ** | CHADS = Cardiac failure, Hypertension, Age, Diabetes, Stroke |
VERGLEICH DER BEHANDLUNGSGRUPPEN: Beide Dabigatrandosierungen sind Warfarin nicht unterlegen. Nur die höhere Dosierung (zweimal 150 mg pro Tag) senkt Schlaganfälle oder systemische Embolien signifikant gegenüber Warfarin, und zwar um absolut 0,60% pro Jahr (siehe Ereignisraten*** in der Tabelle).2-4 Dabei sind systemische Embolien insgesamt selten und unter beiden Mitteln nahezu gleich häufig; Schlaganfälle werden dagegen um 0,57% reduziert. Sowohl leichte als auch zu Behinderung oder Tod führende Insulte treten unter der höheren Dabigatrandosierung seltener auf (um 0,21% bzw. 0,36%), ebenso hämorrhagische oder ischämische (um 0,28% bzw. 0,29%). Kardiovaskuläre Todesfälle werden gegenüber Warfarin um 0,41% pro Jahr vermindert, die Gesamtsterblichkeit grenzwertig signifikant um 0,49%. Unter der niedrigeren Dabigatrandosierung (zweimal 110 mg) sind hämorrhagische Insulte um 0,26% und stationäre Aufnahmen um 1,4% seltener als unter Warfarin.2-4
| *** | Alle Angaben zu Ereignisraten, auch im Text, sind auf ein Jahr bezogen, ausgenommen die zu gastrointestinalen und hepatischen Störwirkungen, die auf den gesamten Studienverlauf bezogen sind. |
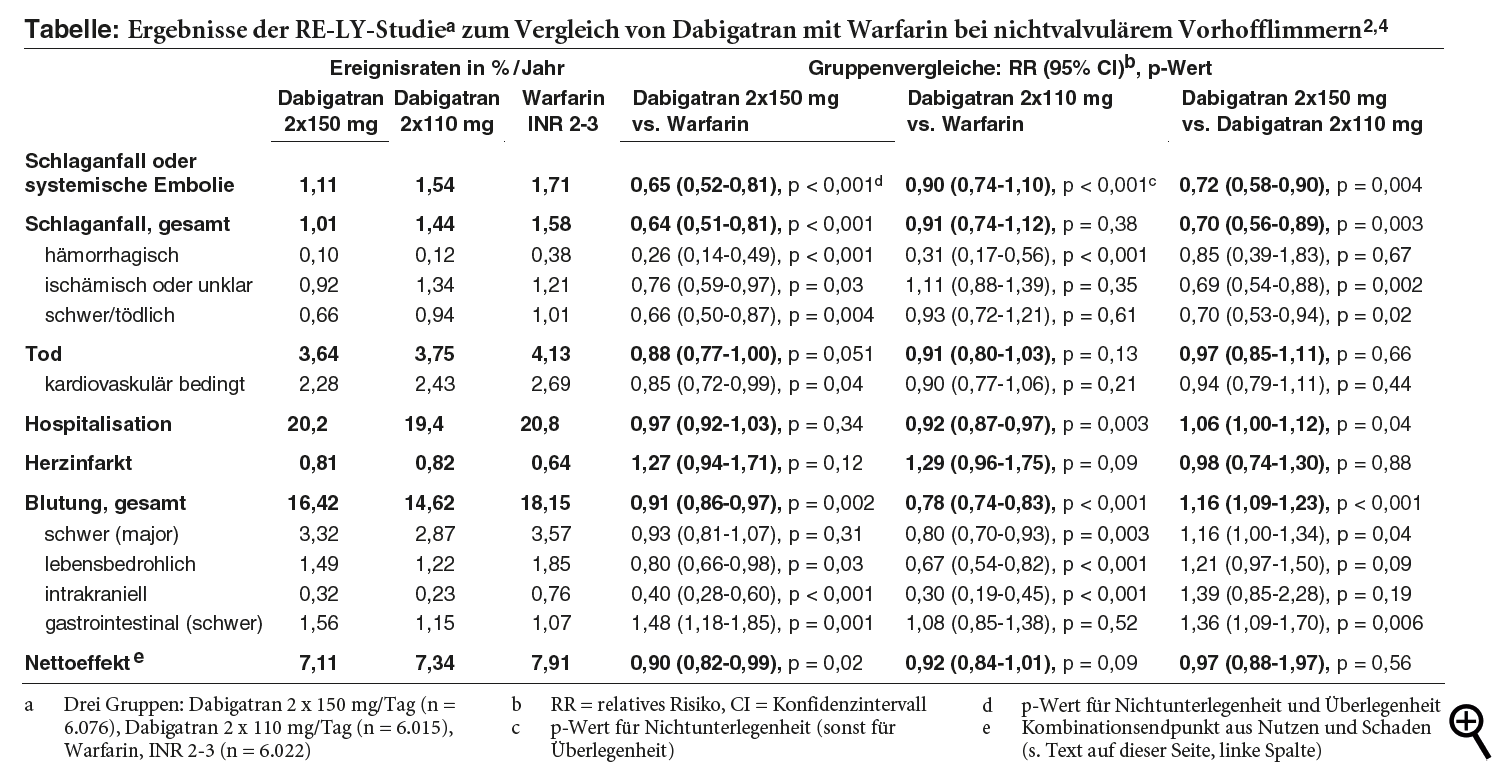
Unter beiden Dabigatrandosierungen**** kommt es tendenziell häufiger als unter Warfarin zu Myokardinfarkten (um 0,17% bzw. 0,18%). Schwere Blutungen sind unter zweimal 110 mg signifikant (um 0,7%), unter zweimal 150 mg nur numerisch seltener. Schwere Magen-Darm-Blutungen treten unter der höheren Dabigatrandosierung sogar signifikant häufiger auf als unter Warfarin (um 0,49%). Intrakranielle (um 0,44% bzw. 0,53%) und lebensbedrohliche Blutungen (um 0,36% bzw. 0,63%) sind jedoch unter beiden Dosierungen seltener. Zur Abschätzung des klinischen Nettoeffektes aus Nutzen und Schaden wird ein kombinierter Endpunkt aus Insult, systemischer oder Lungenembolie, Myokardinfarkt, Tod oder schwerer Blutung prädefiniert. Dieser ist unter zweimal 150 mg signifikant um 0,8% und unter zweimal 110 mg tendenziell um 0,57% seltener als unter Warfarin.2-4
| **** | Ereignisraten im Folgenden - wenn nicht anders bezeichnet - immer in der Reihenfolge: 1. höhere, 2. niedrigere Dabigatrandosierung |
Im Vergleich untereinander verursacht die höhere Dabigatrandosierung mehr schwere Magen-Darm-Blutungen (absolut um 0,41%) und mehr schwere Blutungen insgesamt (um 0,45%) als die niedrigere. Sie verhindert aber auch mehr ischämische Insulte (um 0,42%) und mehr Insulte insgesamt (um 0,43%). Beide Dosierungen führen häufiger zu Dyspepsie als Warfarin (11,3% bzw. 11,8% versus 5,8%) und Therapieabbrüchen wegen gastrointestinaler Beschwerden (2,1% bzw. 2,2% vs. 0,6%). Transaminasenanstiege (1,9% bzw. 2,1% vs. 2,2%) und schwere Leberstörungen (0,5% bzw. 0,6% vs. 0,5%) sind unter beiden Mitteln gleich häufig.2-4
SUBGRUPPEN: Zahlreiche Subgruppen werden mit Hilfe von Interaktionstests analysiert. Geschlecht, Gewicht oder Begleiterkrankungen wie Herzinsuffizienz, Diabetes, Hypertonus oder Vorbehandlung mit ASS sowie der CHADS2-Score haben keinen Einfluss auf die Ergebnisse.2,3 Bei mit oralen Antikoagulanzien vorbehandelten Patienten sind beide Dabigatrandosierungen so wirksam und mindestens so sicher wie bei unvorbehandelten.5 Schlaganfälle oder transitorische ischämische Attacken in der Anamnese beeinflussen die Ergebnisse für Dabigatran eher günstig: Zweimal 110 mg reduzieren dann die kardiovaskuläre und Gesamtmortalität signifikant und hämorrhagische Insulte deutlicher als bei Patienten ohne solche Vorerkrankungen.6
Ein Alter über oder unter 75 Jahre hat keinen Einfluss auf die Reduktion von Insulten und Embolien unter Dabigatran, wohl aber auf schwere Blutungen.2,7,8 Bei den unter 75-Jährigen sind sie unter Dabigatran seltener als unter Warfarin (2,1% bzw. 1,9% vs. 3,4%), bei den über 75-Jährigen dagegen unter zweimal 110 mg gleich häufig wie unter Warfarin (je 4,4%) und unter zweimal 150 mg tendenziell häufiger (5,1%).8 Intrakranielle Blutungen sind allerdings auch bei über 75-Jährigen unter beiden Dabigatrandosierungen seltener als unter Warfarin (0,4% bzw. 0,37% vs. 1%).2,8 Da zweimal 110 mg bei diesen Patienten wie in der Gesamtgruppe Insulte und Embolien gegenüber Warfarin aber nicht reduzieren, bietet diese Dosierung für über 75-Jährige keinen generellen Vorteil.2,7
Bei über 80-Jährigen werden Insulte und Embolien durch beide Dabigatrandosierungen gegenüber Warfarin ähnlich gemindert (1,8% bzw. 1,9% vs. 2,7%). Intrakranielle Blutungen kommen unter zweimal 110 mg seltener vor als unter Warfarin, numerisch auch gegenüber zweimal 150 mg (0,32% vs. 0,69% [2 x 150 mg] bzw. 1,31% [Warfarin]). Somit erscheinen bei über 80-Jährigen zweimal 110 mg Dabigatran gut begründet. Aus der Anwendung in der Routine wird aber bereits über mehrere tödliche Blutungen auch unter dieser Dabigatrandosis bei über 80-Jährigen berichtet.9,10 Bei diesen Patienten, besonders mit Niereninsuffizienz und Untergewicht, wird vor der Verwendung schon gewarnt.11 Für Patienten über 85 Jahre liegen ohnehin keine verwertbaren Daten vor. Bei ihnen sollte Dabigatran nicht eingesetzt werden.2
Obwohl zu 80% renal ausgeschieden, beeinflusst die Nierenfunktion die Ergebnisse für Dabigatran nicht.2,3 Bei leichter oder mäßiger Funktionseinschränkung treten Insulte und Blutungen zwar häufiger auf als bei normaler, aber unter Dabigatran und Warfarin in gleichem Verhältnis. Eine Dosisreduktion bei leichter bis mäßiger Niereninsuffizienz ist meist nicht erforderlich. Bei schwerer Niereninsuffizienz (Clearance unter 30 ml/min) ist Dabigatran kontraindiziert.1,2
Weitere Analysen bieten Hinweise, dass die Region der Studiendurchführung und die Ethnizität der Patienten die Ergebnisse beeinflussen: Patienten in westeuropäischen Zentren oder europäischer und arabischer Herkunft scheinen weniger von Dabigatran zu profitieren.3 Grund könnte eine bessere Einstellung der INR-Werte unter Warfarin sein: In europäischen Zentren liegen sie im Mittel mehr als 70% der Studienzeit im therapeutischen Bereich, in allen Zentren zusammen nur mehr als 64%.2,3 In Zentren mit INR-Werten über mehr als 72,6% im therapeutischen Bereich (oberes Quartil der Studie) verhindern zweimal 150 mg Dabigatran Insulte oder Embolien wahrscheinlich nicht besser als Warfarin (Hazard Ratio [HR] 0,95; Interaktionstest***** p = 0,20). Ischämische Insulte oder Embolien sind numerisch sogar häufiger (HR 1,21; Interaktionstest p = 0,076). Beide Dabigatrandosierungen haben dann beim klinischen Nettoeffekt (HR 1,11 bzw. 1,07; Interaktionstest p = 0,0006 bzw. p = 0,036) und der Mortalität (HR 1,08 bzw. 1,18; Interaktionstest p = 0,052 bzw. p = 0,066) numerisch Nachteile gegenüber Warfarin. In Zentren, in denen die INR-Werte lediglich mehr als 65,5% der Zeit im therapeutischen Bereich liegen (obere zwei Quartile), sind unter der höheren Dabigatrandosierung schwere Blutungen numerisch und schwere Magen-Darm-Blutungen signifikant häufiger als unter Warfarin (HR 1,13-1,16 bzw. 2,00-2,26; Interaktionstest p = 0,03 bzw. p = 0,019).12 Ob diese Zentren-bezogenen Auswertungen problemlos auf die INR-Einstellung individueller Patienten übertragbar sind, wird kritisch angesehen.13 Dennoch geben die Daten einen klaren Hinweis darauf, dass Dabigatran bei Patienten mit guter INR-Einstellung keine Vorteile gegenüber Warfarin bietet.2,13,27
| ***** | Im Interaktionstest wird (mit einem statistischen Verfahren) gemessen, ob ein Subgruppenmerkmal (hier z.B. die Güte der INR-Einstellung in Studienzentren) Einfluss hat auf das Studienergebnis. Ab einem p-Wert von 0,2 im Interaktionstest ist nach IQWiG von einem Hinweis auf unterschiedliche Effekte in Subgruppen auszugehen, ab einem p-Wert von 0,05 von einem Beleg.28 |
STUDIENQUALITÄT: Durchführung und Methodik der Studie weisen Schwächen auf. 32% der Patienten haben einen CHADS2-Score von 0 oder 1. Nach bisherigen europäischen14 und amerikanischen Leitlinien15 sollten solche Patienten mit oralen Antikoagulanzien oder ASS behandelt werden. Vergleiche von Dabigatran gegenüber ASS bei Patienten mit nur einem klinisch relevanten, aber keinem Major-Risikofaktor fehlen. Der Verzicht auf eine Verblindung zwischen Dabigatran und Warfarin könnte zu Verzerrungen bei der Betreuung der Patienten und Erhebung der Endpunkte geführt haben.7,16 Es fehlen Per-Protokoll-Analysen, die bei Nichtunterlegenheitsstudien zusätzlich gefordert werden und in der Regel zu konservativeren Ergebnissen führen.17 In der Gesamtschau der Daten scheinen uns die Schwächen der Studie jedoch nicht so gravierend zu sein, dass die Validität der Ergebnisse in Zweifel gezogen werden müsste.
OFFENE FRAGEN FÜR DIE ANWENDUNG IN DER PRAXIS: Je nach Größe und Blutungsrisiko des Eingriffs soll Dabigatran 24 bis 48 Stunden vor Operationen abgesetzt werden, bei mäßig eingeschränkter Nierenfunktion schon zwei bis vier Tage vorher. Ist ein Bridging geplant, soll zwölf Stunden nach der letzten Dabigatrandosis mit Heparin begonnen werden.1 Das Bridging selbst soll dann wie üblich erfolgen (siehe a-t 2004; 35: 94-6). Publizierte Erfahrungen zu diesen Empfehlungen liegen jedoch noch nicht vor. Kardioversionen scheinen unter laufender Therapie möglich: Gut 10% der Patienten in RE-LY werden elektrisch oder medikamentös kardiovertiert. Schlaganfälle oder Embolien und schwere Blutungen sind in den folgenden 30 Tagen unter Dabigatran und Warfarin gleich häufig - bei allerdings geringen Ereignisraten.18 Die gleichzeitige systemische Anwendung starker Hemmstoffe des p-Glykoproteins wie Ciclosporin A (SANDIMMUN, Generika) oder Itraconazol (SEMPERA, Generika) ist kontraindiziert, die Anwendung von Verapamil (ISOPTIN, Generika), Chinidin (in: CORDICHIN) und Amiodaron (CORDAREX, Generika) erfordert besondere Vorsicht und ggf. eine Dosisreduktion von Dabigatran.1 Plättchenhemmer wie ASS oder Clopidogrel (PLAVIX, Generika) erhöhen das Blutungsrisiko unter Dabigatran wie unter Warfarin auf das Zweifache, nichtsteroidale Antirheumatika um 50%.19 Anders als für Cumarine steht bei bedrohlichen Blutungen kein Antidot zur Verfügung.
KOSTEN: Die Tagestherapiekosten für Dabigatran liegen 15- bis 20fach über denjenigen für Phenprocoumon (MARCUMAR, Generika). Nach US-amerikanischen Modellrechnungen soll Dabigatran vor allem bei Patienten mit hohem Insult- oder Blutungsrisiko und folglich häufigen INR-Messungen und hohem Betreuungsaufwand kosteneffektiv sein.20 Solche Analysen sind Länder- und Gesundheitssystem-spezifisch und somit nicht problemlos auf Deutschland übertragbar. Die Erfahrungen mit der INR-Einstellung sollen in Europa zudem größer, das Netz der Zentren dichter und die Kosten der INR-Messung geringer sein.21 Das britische NICE fordert vor einer Erstattung von Dabigatran weitere und für bestimmte Patientengruppen spezifische Kosteneffektivitätsanalysen.22 Hierzulande liegen die Jahreskosten für Dabigatran derzeit rund 1.000 € über denen für ein Cumarin einschließlich einer (eher häufigen) INR-Messung alle zwei Wochen. Bezogen auf den klinischen Nettoeffekt in RE-LY, bei dem sich unter der höheren Dabigatrandosierung gegenüber Warfarin ein Vorteil von 0,8% pro Jahr ergibt (Number needed to treat = 125/Jahr), müssen für ein verhindertes Ereignis demnach 125.000 € aufgewendet werden. Nicht berücksichtigt bliebe hierbei zwar der in € schwer taxierbare Mehraufwand durch häufigere Arztkontakte unter Cumarinbehandlung. Gerade letztere dürften andererseits zur Sicherheit der Antikoagulation beitragen.

RIVAROXABAN UND APIXABAN: Mittlerweile sind auch die beiden Studien zum Vergleich von Rivaroxaban (XARELTO; ROCKET AF******) und Apixaban (ELIQUIS; ARISTOTLE******) mit Warfarin in der Prophylaxe von Insulten und systemischen Embolien bei Patienten mit nichtvalvulärem Vorhofflimmern abgeschlossen und publiziert.23,24 Sie ähneln nach Größe, Design, Durchführung und untersuchten Endpunkten der RE-LY-Studie. Einzelne methodische Unterschiede könnten jedoch für eine vergleichende Bewertung bedeutsam sein. Nach den publizierten Daten vermindert Rivaroxaban Insulte und Embolien gegenüber Warfarin um 0,5% pro Jahr bei gleicher Rate schwerer Blutungen, Apixaban um 0,33% pro Jahr bei gleichzeitig um knapp 1% reduzierter Rate schwerer Blutungen. Rivaroxaban scheint die Mortalität nicht signifikant um 0,3% und Apixaban signifikant um 0,42% zu reduzieren. Unter keinem der beiden Mittel wird eine Zunahme von Infarkten gegenüber Warfarin beschrieben. Eine kritische Bewertung der Ergebnisse wird erst möglich sein, wenn im Rahmen der Zulassungsanträge den Behörden detaillierte Daten vorgelegt und möglicherweise auch noch nachgereicht werden. Wesentliche Unterschiede im Vergleich zu den Ergebnissen für Dabigatran werden aber derzeit nicht gesehen.25,26 Beide Faktor-Xa-Inhibitoren sind bisher auch in anderen Ländern nur zur Prophylaxe von Thromboembolien nach Hüft- und Kniegelenksersatz zugelassen (a-t 2008; 39: 109-11 und 2011; 42: 59-60). Die zu erwartenden Zulassungserweiterungen für Rivaroxaban und Apixaban könnten die Preisgestaltung und Bewertung von Dabigatran durchaus noch beeinflussen.
| ****** | ARISTOTLE = Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation ROCKET AF = Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation |
Mit Dabigatran (PRADAXA) ist erstmals eine per os anwendbare Alternative zu Cumarinen für Patienten mit nichtvalvulärem Vorhofflimmern verfügbar, die einer Antikoagulation bedürfen.
Dabigatran ist hierfür in Stärken von 150 mg und 110 mg zugelassen, die zweimal täglich eingenommen werden müssen. Laborkontrollen sind für die Routine nicht nötig, aber auch nicht verfügbar.
Zweimal täglich 150 mg reduzieren gegenüber Warfarin (COUMADIN) die Schlaganfallrate um absolut gut 0,5% pro Jahr. Auch tödliche oder zur Behinderung führende und hämorrhagische Schlaganfälle sind seltener.
Die kardiovaskuläre Mortalität sinkt um gut 0,4%, die Gesamtmortalität grenzwertig signifikant um knapp 0,5%.
Schwere Blutungen insgesamt sind unter zweimal 150 mg nicht seltener als unter Warfarin. Unter den schweren Blutungen sind intrakranielle gut 0,4% seltener, gastrointestinale aber knapp 0,5% häufiger.
Zweimal täglich 110 mg verhindern Schlaganfälle insgesamt nicht besser als Warfarin, wohl aber hämorrhagische. Die Mortalität wird nicht beeinflusst.
Schwere Blutungen und darunter auch intrakranielle sind unter zweimal 110 mg seltener als unter Warfarin. Gastrointestinale Blutungen nehmen nicht zu.
Insgesamt erscheinen zweimal 150 mg als die bessere Alternative zu Warfarin als zweimal 110 mg. Dies gilt auch für Patienten mit leicht bis mäßig eingeschränkter Nierenfunktion oder über 75 Jahre. Nur für 80- bis 85-Jährige ist die niedrigere Dosis die bessere Wahl.
Wegen unzureichender Daten sollte Dabigatran bei Patienten über 85 Jahren nicht angewendet werden. Bei schwerer Niereninsuffizienz ist es kontraindiziert.
Unter beiden Dosierungen nimmt die Herzinfarktrate numerisch zu. Übelkeit und Therapieabbrüche wegen Magen-Darm-Beschwerden sind häufiger als unter Warfarin.
Nach Subgruppenanalysen profitieren Patienten, die in Zentren mit (sehr) gutem INR-Monitoring betreut werden, wenig bis gar nicht von einer Umstellung auf Dabigatran.
Auch unter Berücksichtigung des Wegfalls der INR-Messungen verteuert Dabigatran die Behandlung von nichtvalvulärem Vorhofflimmern erheblich.
Wir sehen eine mögliche Indikation für Dabigatran vor allem für Patienten mit hohem Insult- und/oder Blutungsrisiko, bei denen sich die INR-Einstellung unter Cumarinantikoagulanzien schwierig gestaltet.
| (R =randomisierte Studie) | |
| 1 | Boehringer Ingelheim: Fachinformation PRADAXA 150 mg und 110 mg, Stand Aug. 2011 |
| 2 | EMA: Europ. Beurteilungsbericht (EPAR) PRADAXA, Stand 9. Juni 2011 http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Assessment_Report_-_Variation/human/000829/WC500110875.pdf |
| R 3 | CONNOLLY, S.J. et al.: N. Engl. J. Med. 2009; 361: 1139-51 |
| 4 | CONNOLLY, S.J. et al.: N. Engl. J. Med. 2010; 363: 1875-6 |
| R 5 | EZEKOWITZ, M.D. et al.: Circulation 2010; 122: 2246-53 |
| R 6 | DIENER, H.C. et al.: Lancet Neurol. 2010; 9: 1157-63 |
| 7 | FDA: Briefing Information, Advisory Committee Meeting 20. Sept. 2010 http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/ CardiovascularandRenalDrugsAdvisoryCommittee/UCM247244.pdf |
| R 8 | EIKELBOOM, J.W. et al.: Circulation 2011; 123: 2363-72 |
| 9 | LEGRAND, M. et al.: Arch. Intern. Med. 2011; 171: 1285-6 |
| 10 | Scrip 2011; Nr. 3562: 1 |
| 11 | JACOBS, J.M., STESSMAN, J.: Arch. Intern. Med. 2011; 171: 1287-8 |
| R 12 | WALLENTIN, L. et al.: Lancet 2010; 376: 975-83 |
| 13 | LANE, D.A., LIP, G.Y.H.: Lancet 2010: 376: 935-7 |
| 14 | CAMM, A.J. et al.: Eur. Heart J. 2010; 31: 2369-429 |
| 15 | FUSTER, V. et al.: Europace 2006; 8: 651-745 |
| 16 | Therapeutics Letter, Jan.-März 2011 http://www.ti.ubc.ca/sites/ti.ubc.ca/files/80.pdf |
| 17 | CPMP: Points to Consider on Switching between Superiority and Non-Inferiority, 27. Juli 2000; http://www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2009/09/WC500003658.pdf |
| R 18 | NAGARAKANTI, R. et al.: Circulation 2011; 123: 131-6 |
| 19 | Boehringer Ingelheim: Briefing Document, Advisory Committee Meeting 20. Sept. 2010; http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/ Drugs/CardiovascularandRenalDrugsAdvisoryCommittee/UCM226009.pdf |
| 20 | SHAH, S.V., GAGE, B.F.: Circulation 2011; 123: 2562-70 |
| 21 | BRUCE, F.: Scrip News, 17. Aug. 2011 |
| 22 | NICE: Presseerklärung vom 17. Aug. 2011; http://www.nice.org.uk/newsroom/pressreleases/DabigatranForAFConsultation.jsp |
| R 23 | PATEL, M.R. et al.: N. Engl. J. Med. 2011; 365: 883-91 |
| R 24 | GRANGER, C.B. et al.: N. Engl. J. Med. 2011; online publiziert am 28. Aug. 2011 |
| 25 | del ZOPPO, G.J., ELIASZIW, M.: N. Engl. J. Med. 2011; 365: 952-3 |
| 26 | MEGA, J.L.: N. Engl. J. Med. 2011; online publiziert am 28. Aug. 2011 |
| 27 | DOUKETIS, J.D.: Pol. Arch. Med. Wiewn 2011; 121: 73-80 |
| 28 | IQWiG: Allgemeine Methoden. Entwurf für Version 4.0, 9. März 2011 https://www.iqwig.de/download/IQWiG_Entwurf_Methoden_Version_4-0.pdf |
© 2011 arznei-telegramm, publiziert am 16. September 2011
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
