Erst im zweiten Anlauf nach einem gescheiterten Versuch Ende der 90er Jahre1 ist das Antiepileptikum  Zonisamid (ZONEGRAN) im Juni 2005 in Europa zugelassen worden. Die Entwicklung des Produkts wurde in den 80er Jahren
zunächst eingestellt, weil sich unter der Einnahme unverhältnismäßig häufig Nierensteine bilden.2 Zonisamid (ZONEGRAN) im Juni 2005 in Europa zugelassen worden. Die Entwicklung des Produkts wurde in den 80er Jahren
zunächst eingestellt, weil sich unter der Einnahme unverhältnismäßig häufig Nierensteine bilden.2
Zonisamid wird jetzt zur Zusatztherapie partieller Anfälle mit und ohne Generalisierung bei Erwachsenen angeboten. Chemisch besteht keine Verwandtschaft mit
gebräuchlichen Antiepileptika, wohl aber mit Benzisoxazolderivaten wie dem Neuroleptikum Risperidon (RISPERDAL). Zonisamid enthält wie Sultiam
(OSPOLOT) eine Sulfonamidgruppe.3
EIGENSCHAFTEN: Zonisamid soll die zentralnervöse Erregbarkeit durch Blockade spannungsabhängiger Natrium- und
Kalziumkanäle mindern.3 Zudem wirkt es auf das GABAerge-System.1 Ähnlich wie Topiramat (TOPAMAX) und viele Sulfonamide hemmt
es die Karboanhydrase.3 Der genaue Wirkmechanismus ist jedoch nicht bekannt.3
Zonisamid muss langsam aufdosiert werden. Die maximale Plasmakonzentration wird innerhalb von zwei bis sechs Stunden erreicht, deutlich höhere
Konzentrationen werden unter anderem im Gehirn und in Erythrozyten gemessen.1 Die Plasmahalbwertszeit ist mit drei Tagen (68 Stunden) lang. Nach
vorwiegender Metabolisierung über CYP3A4 wird es vor allem renal ausgeschieden. Bei Patienten mit eingeschränkter Nierenfunktion ist daher Vorsicht
geboten, bei Leberfunktionsstörung wird die Anwendung nicht empfohlen.3,4 Bei Dosisänderung gleichzeitig eingenommener CYP3A4-
induzierender Antiepileptika wie Phenytoin (PHENHYDAN u.a.) kann eine Dosisanpassung von Zonisamid erforderlich werden.
KLINISCHE WIRKSAMKEIT: Die europäische Arzneimittelbehörde (EMEA) hat nach dem ersten gescheiterten Zulassungsantrag eine weitere
Studie verlangt. Die Behandlungsdauer in den bis dahin vorliegenden Studien ist nach Ansicht der Behörde für einen Wirksamkeitsnachweis zu kurz.
Zweifel daran, ob der Nutzen anhält, bestehen auch wegen der in offenen Untersuchungen beobachteten hohen Abbruchraten von 30% bis 40% aufgrund
mangelnder Wirksamkeit. Die europäische Zulassung basiert jetzt wesentlich auf einer zwischen 2000 und 2002 durchgeführten Studie mit 351
durchschnittlich 36 Jahre alten Patienten, die trotz Einnahme von ein bis drei Antiepileptika unter partiellen Anfällen leiden. In der zwölfwöchigen
Eingangsphase der Studie müssen mindestens zwölf Anfälle aufgetreten sein. Nach einer Titrationsphase von sechs Wochen nehmen die Patienten
dann 18 Wochen lang zusätzlich zur bisherigen Medikation täglich 100 mg, 300 mg oder 500 mg Zonisamid oder Plazebo ein.1,5
Für einen zufriedenstellenden Nutzennachweis reicht auch die Zulassungsstudie nicht aus: Ihre primäre Fragestellung ist die Wirksamkeit von Zonisamid
bei komplexen partiellen Anfällen in den 18 Wochen mit stabiler Dosis. Patienten mit komplexen partiellen Anfällen bilden aber nur eine Subgruppe. Da
zudem die Nachbeobachtung unvollständig ist, gehen in die primäre Analyse lediglich 68% der Patienten ein. Unter 500 mg Zonisamid soll sich danach die
Anfallshäufigkeit bei der Hälfte der Patienten um mindestens 51% reduzieren im Vergleich zu einer medianen Minderung um 16% unter Plazebo. 100 mg
und 300 mg Zonisamid unterscheiden sich nicht signifikant vom Scheinmedikament. Zwar ergibt sich auch bei Intention-to-treat-Analyse und Betrachtung aller
partiellen Anfälle ein signifikanter Effekt der höheren Zonisamid-Dosierungen (Reduktion der Anfallshäufigkeit unter 500 mg, 300 mg und Plazebo bei
der Hälfte der Patienten um mindestens 45%, 41% bzw. 19%).1,5 Für einen Effekt spricht zudem die Konsistenz der Ergebnisse in den
verschiedenen Auswertungen. Da die methodisch wichtigste Intention-to-treat-Auswertung aber nur eine von multiplen sekundären Analysen darstellt und nur
76% der Patienten die Studie abschließen, ist ihre Aussagekraft gering. Die EMEA bezweifelt zudem die klinische Relevanz des Effektes, unter anderem wegen
des medianen Zugewinns von nur drei anfallsfreien Tagen in vier Wochen unter der Therapie.1
STÖRWIRKUNGEN: Mit jeweils mehr als 10% stehen neurologische Schadwirkungen wie Ataxie, Diplopie und kognitive Beeinträchtigung wie
gestörtes Gedächtnis sowie psychiatrische Störwirkungen wie Depression, Agitiertheit, Reizbarkeit und Verwirrtheitszustand im
Vordergrund.4 Wegen Psychose oder psychotischer Symptome müssen in kontrollierten Studien unter Zonisamid 2,2% der Patienten stationär
behandelt werden oder die Einnahme abbrechen, dagegen keiner unter Plazebo. Auch das Suizidrisiko ist unter Zonisamid höher: 1,1% vs. 0,4% unter Plazebo
unternehmen einen Suizidversuch.3 Gastrointestinale Beschwerden wie Schmerzen, Übelkeit, Durchfall und Gewichtsabnahme sowie Fieber und
Hautausschlag sind ebenfalls häufig.4
Als Sulfonamidabkömmling kann Zonisamid lebensbedrohliche Überempfindlichkeitsreaktionen hervorrufen. STEVENS-JOHNSON-Syndrom, toxische
epidermale Nekrolyse, zum Teil mit tödlichem Verlauf, aplastische Anämie und Agranulozytose sind beschrieben. Bei Zeichen von Hypersensitivität
oder anderen schwerwiegenden Reaktionen muss Zonisamid sofort abgesetzt werden. Auch bei Hautausschlag erscheint Absetzen ratsam.3,4 Aus
Erfahrungen mit Langzeitsulfonamiden lässt sich ableiten, dass Kumulation ein Risiko der lebensbedrohlichen Verschlechterung bedeuten kann. Bei
Sulfonamidüberempfindlichkeit ist Zonisamid kontraindiziert.3,4
Das Antiepileptikum kann die Nierenfunktion verschlechtern. Bei akutem Nierenversagen, aber auch bei klinisch bedeutsamem anhaltenden Anstieg von Kreatinin
oder Harnstoff, soll es ebenfalls abgesetzt werden.3 Ähnlich wie bei Topiramat, das ebenfalls die Karboanhydrase hemmt, werden außer
Nierensteinen (4%) auch metabolische Azidose, Oligohydrosis und Hitzschlag, insbesondere bei Kindern, beobachtet.3,4 Auch Rhabdomyolyse ist
beschrieben.4
Verschlechterung der Epilepsie unter Zonisamid ist möglich: In einer der älteren Studien nimmt die Anfallsfrequenz bei jedem fünften Patienten um
mindestens 50% zu.6 Laut US-amerikanischer Fachinformation wird ein Status epilepticus in kontrollierten Studien bei 1% der Zonisamid-Anwender
beobachtet, dagegen bei keinem unter Plazebo.3
Zonisamid wirkt bei allen untersuchten Tierspezies schon in therapeutischen Dosierungen teratogen und embryotoxisch. Insbesondere fallen Herz- und
Gefäßfehlbildungen sowie Ossifikationsstörungen auf.2
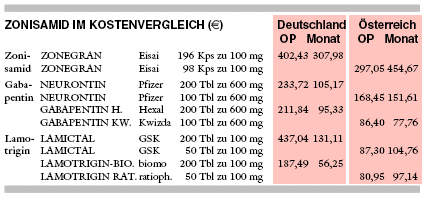
KOSTEN: Mit 308 € monatlich bei täglich 500 mg Zonisamid ist das Zusatzantiepileptikum dreimal so teuer wie Gabapentin (dreimal täglich
600 mg, 95 € für GABAPENTIN HEXAL) und bis zu fünfmal so teuer wie Lamotrigin (zweimal täglich 100 mg, 56 € für LAMOTRIGIN
BIOMO).
 Seit Juni steht Seit Juni steht  Zonisamid (ZONEGRAN) als weiteres Zusatzantiepileptikum bei partiellen Anfällen Erwachsener zur Verfügung. Zonisamid (ZONEGRAN) als weiteres Zusatzantiepileptikum bei partiellen Anfällen Erwachsener zur Verfügung.
 Täglich 300 mg bzw. 500 mg Zonisamid als Ergänzung zur bisherigen
Medikation sollen die Anfallshäufigkeit bei der Hälfte der Patienten um mindestens 41% bzw. 45% senken im Vergleich zu mindestens 19% unter Plazebo.
Aufgrund methodischer Mängel der Zulassungsstudie lässt sich der Nutzen des Mittels jedoch nicht definitiv bewerten. Täglich 300 mg bzw. 500 mg Zonisamid als Ergänzung zur bisherigen
Medikation sollen die Anfallshäufigkeit bei der Hälfte der Patienten um mindestens 41% bzw. 45% senken im Vergleich zu mindestens 19% unter Plazebo.
Aufgrund methodischer Mängel der Zulassungsstudie lässt sich der Nutzen des Mittels jedoch nicht definitiv bewerten.
 Selbst die zulassende Behörde EMEA äußert Zweifel an der
klinischen Relevanz beobachteter Effekte. Selbst die zulassende Behörde EMEA äußert Zweifel an der
klinischen Relevanz beobachteter Effekte.
 Ob die Wirksamkeit bei längerer Einnahme anhält, ist fraglich. Kontrollierte
randomisierte Langzeitstudien zu Wirksamkeit und Sicherheit fehlen. Ob die Wirksamkeit bei längerer Einnahme anhält, ist fraglich. Kontrollierte
randomisierte Langzeitstudien zu Wirksamkeit und Sicherheit fehlen.
 Insbesondere häufige schwerwiegende psychiatrische Schadwirkungen wie
Psychose und Depression sowie kognitive Einbußen stimmen bedenklich. Mit Überempfindlichkeitsreaktionen auf den Sulfonamidabkömmling und
häufigen Nierensteinen ist zu rechnen. Insbesondere häufige schwerwiegende psychiatrische Schadwirkungen wie
Psychose und Depression sowie kognitive Einbußen stimmen bedenklich. Mit Überempfindlichkeitsreaktionen auf den Sulfonamidabkömmling und
häufigen Nierensteinen ist zu rechnen.
 Die Zulassung von Zonisamid können wir auf der vorhandenen Datenbasis
nicht nachvollziehen. Die Zulassung von Zonisamid können wir auf der vorhandenen Datenbasis
nicht nachvollziehen.
|

