Primärbehandlung der chronisch myeloischenLeukämie mit Imatinib (GLIVEC): Der Tyrosinkinase-Hemmer Imatinib (GLIVEC) wurde
Ende 2001 im Rekordtempo für die Behandlung der chronisch myeloischen Leukämie (CML) nach Versagen von Interferon alfa (INF α,
INTRONA u.a.) zugelassen. Die Kenntnisse zu dem Mittel beruhten auf unkontrollierten Phase-2-Studien, die nur Surrogatparameter prüfen (a-t 2001; 32: 117-8). Diese erlauben keinen Rückschluss auf die Überlebenschancen (BACCARANI, M. et al.:
Blood 2002; 99: 1527-35). Aufgrund positiver Zwischenergebnisse einer offenen randomisierten Vergleichsstudie (IRIS*) mit INF ( plus Cytarabin (ALEXAN, UDICIL)
wurde die Zulassung von Imatinib Anfang des Jahres auf die Primärbehandlung der CML erweitert. Die Daten nach medianer Nachbeobachtung von 19
Monaten werden jetzt veröffentlicht: 1.106 Patienten mit nicht vorbehandelter CML nehmen entweder täglich 400 mg Imatinib ein oder erhalten subkutan
INF ( je nach Verträglichkeit bis 5 Mio. E./m2 Körperoberfläche/Tag sowie nach Erreichen der tolerierten Zieldosis zusätzlich 20 mg bis 40 mg
Cytarabin/m2 an zehn Tagen pro Monat. Bei primärem oder sekundärem Therapieversagen sowie bei Unverträglichkeit ist ein Wechsel der
Behandlungsgruppe möglich. Nachträglich wird als weiterer Grund die Ablehnung des Kombinationsregimes eingeführt, vermutlich als Reaktion auf
die hohe Rate an Studienabbrechern nach Zulassung von Imatinib in den USA. Zum Zeitpunkt der Auswertung wenden nur noch 11% der ursprünglich der
INF-Gruppe zugeteilten Patienten dieses Regime an im Vergleich zu 86% der Imatinib-Gruppe. 32% scheiden unter INF vorzeitig aus der Studie aus. 58% wechseln
die Behandlung, hauptsächlich wegen Unverträglichkeit. Unter dem Tyrosinkinase-Hemmer sind es 12% bzw. 2%. Den primären Endpunkt,
progressionsfreies Überleben, erreichen nach 18 Monaten unter Imatinib mit 92% deutlich mehr Patienten als unter INF ( (74%). Die reinen Überlebensraten
unterscheiden sich jedoch nicht signifikant (97% versus 95%) - wie angesichts der kurzen Laufzeit zu erwarten. Unter dem Tyrosinkinase-Hemmer sind zu diesem
Zeitpunkt noch 97% in kompletter hämatologischer Remission (ein sekundärer Endpunkt) im Vergleich zu 69% unter der Kombination. Die hohe Rate an
Studienabbrechern und Wechslern erschwert die Interpretation der Ergebnisse erheblich, zumal sich nicht erkennen lässt, wie vollständig die
Nachbeobachtung ist. Das Kombinationsregime könnte sowohl über- als auch unterschätzt sein. Ob die Primärbehandlung mit Imatinib
langfristig einen Überlebensvorteil bietet, lässt sich in dieser Untersuchung vermutlich nicht mehr klären (O'BRIEN, S.G. et al.: N. Engl. J. Med. 2003;
348: 994-1004/ati d). Imatinib-Hersteller Novartis bezahlt die Studie nicht nur, sondern ist auch verantwortlich für Design, Datenanalyse und -interpretation. Die
Untersuchung soll fortgesetzt werden. Zu hoffen ist, dass künftig auch längerfristige Erfahrungen mit Imatinib veröffentlicht werden, z.B. zum
Ausmaß und Effekt einer Resistenzentwicklung gegen den Tyrosinkinase-Hemmer, -Red.
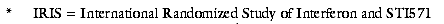
| © 2003 arznei-telegramm |
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
