IMATINIB (GLIVEC) GEGEN CHRONISCH MYELOISCHE LEUKÄMIE |
Seit November bietet Novartis zur Behandlung der chronisch myeloischen Leukämie (CML) den Tyrosinkinase-Hemmstoff Imatinib (GLIVEC) an.
Nach nur drei Jahren klinischer Forschung hat die US-amerikanische Arzneimittelbehörde FDA das Mittel im Mai dieses Jahres zugelassen,1 kurz
darauf auch die europäische Behörde EMEA. Dieser neue Rekord in der Zulassungsgeschwindigkeit wird möglicherweise zur Folge haben, dass
Qualitäts- und Sicherheitsstandards in der Therapie untergraben werden, weil die Kenntnisse zu dem Mittel auf der Stufe unkontrollierter Phase-2-Studien, die
nur Surrogatparameter prüfen, stehen bleiben. EIGENSCHAFTEN: Imatinib wird nach Einnahme per os gut absorbiert. Es wird in der Leber primär durch CYP 3A4 verstoffwechselt, weniger auch durch andere CYP-Enzyme, wobei es selbst CYP 3A4, 2C9 und 2D6 hemmt (vgl. a-t 2001; 32: 89-91). Die Eliminationshalbwertszeit der Muttersubstanz beträgt 18 Stunden, die des wichtigsten aktiven Metaboliten 40 Stunden.3 Imatinib wirkt nicht völlig spezifisch, sondern hemmt auch einige andere Tyrosinkinasen, z.B. den Platelet-Derived-Growth-Factor-Rezeptor. KLINISCHE STUDIEN: Aus der klinischen Prüfung wurden bislang nur die Zwischenergebnisse von zwei kleinen unkontrollierten Phase-1- bzw.
Pilotstudien publiziert. Täglich 300 mg Imatinib oder mehr erzielen bei 53 (98%) von 54 Patienten in der chronischen Phase der CML nach Versagen oder
Unverträglichkeit von Interferon α eine komplette hämatologische Remission, meist innerhalb von vier Wochen. Zur kompletten zytogenetischen
Remission kommt es bei 7 (13%) Patienten. Innerhalb der bisherigen Nachbeobachtung von 265 Tagen im Median hält die hämatologische Remission bei
51 (96%) der 53 Responder an.5 Ob das Mittel nach Erreichen einer anhaltenden Remission abgesetzt werden kann, ist nicht bekannt.3 Die
kompletten Ansprechraten bei 38 Patienten mit Blastenschub betragen 11% und 9%. Knapp die Hälfte der Responder mit Blastenschub erleidet aber innerhalb
von 6 Monaten einen Rückfall,6 offensichtlich weil sich Resistenzen gegen Imatinib ausbilden.7 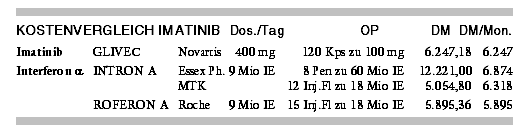
FAZIT: : Im Rekordtempo hat der Tyrosinkinase-Hemmer Imatinib (GLIVEC) nach nur drei Jahren klinischer Erprobung in den USA und Europa die
Marktzulassung zur Behandlung der chronisch myeloischen Leukämie (CML) erhalten. Imatinib könnte einen Fortschritt in der CML-Therapie darstellen.
Bislang ist aber nur ein zum Teil kurzfristiger Effekt auf Surrogatparameter (hämatologische und zytogenetische Ansprechrate) belegt. Wie sich das Mittel auf die
Überlebenschance auswirkt, ist nicht bekannt. 

|
| © 2001 arznei-telegramm |
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
