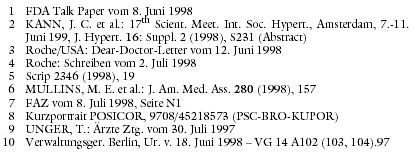
Für die amerikanische Arzneimittelbehörde FDA gilt der T-Kanalblocker Mibefradil (CERATE, POSICOR) wegen seines beträchtlichen
Interaktionspotentials als "unvertretbares Risiko", da er "keine besonderen Vorteile erkennen lässt (wie Nutzen bei Patienten, die auf andere
Antihypertensiva und Angina-pectoris-Mittel nicht ansprechen)".1 Mit ähnlicher Begründung brach die Ethikkommission in Innsbruck bereits
zum Jahreswechsel eine Phase-IV-Studie mit Mibefradil ab. Die weltweite Marktrücknahme von POSICOR durch Roche (a-t 6 [1998], 53) hat das Gefährdungspotential jedoch noch nicht beseitigt. Die Firma versäumte es
zunächst, auf lebensbedrohliche Risiken beim Umstellen hinzuweisen und ließ noch nach Marktrücknahme Daten zum angeblich "besseren
Sicherheitsprofil" von Mibefradil im Vergleich zu anderen Antihypertensiva verbreiten.2
Es kann 7 bis 14 Tage dauern, bis Mibefradil und seine Metaboliten ausgeschieden sind und keine Interaktionsgefahr mehr besteht (siehe Kasten). Dies
erläutert die Firma in den USA erst Tage nach Rücknahme des Produktes in einem Dear-Doctor-Letter.3 In Deutschland verzichtet Roche auf
einen entsprechenden Rote-Hand-Brief und überlässt die Warnung Pharmareferenten,4 die wohl kaum zeitgerecht flächendeckend
informieren können. Bereits Monate zuvor erhielt der Konzern Berichte über bedrohliche Absetzfolgen, befand aber, dass sich "eine Kausalität
nicht belegen ließ."5 Doch allein schon die Information der Ärzte über den Verdacht hätte Patientenleben erhalten oder
intensivmedizinische Maßnahmen vermeiden können. Der von Firmen immer wieder bei Schadwirkungen geforderte Kausalitätsnachweis entpuppt
sich als Ausrede zur "Reinhaltung" des Produktprofils und verhindert Erkenntnisgewinn und Maßnahmen zur Risikoabwehr. Soeben werden vier
lebensbedrohliche Ereignisse mit kardiogenem Schock veröffentlicht, die eine bis zwölf Stunden nach Wechsel auf Nifedipin (ADALAT u.a.), Nisoldipin
(BAYMYCARD) oder Felodipin (MODIP, MUNOBAL) auftraten, z.T. in Kombination mit anderen Antihypertensiva. Eine Frau ist verstorben.6
ABSETZEN VON MIBEFRADIL - Wann darf eine Therapie mit anderen Antihypertensiva begonnen werden?3
- Nach 14 Tagen: Felodipin (MODIP, MUNOBAL) oder Timolol (in MODUCRIN).
- Nach 7 Tagen: andere Kalziumantagonisten (außer Felodipin) oder Betarezeptorenblocker (außer Timolol).
- Nach 2 bis 3 Tagen: Atenolol (TENORMIN u.a.) oder Amlodipin (NORVASC).
- Kein zeitlicher Abstand: ACE-Hemmer, Angiotensin-II-Antagonisten, Diuretika, Nitrate u.a.
|
Weltweit setzen Zulassungsbehörden zunehmend auf Schnelligkeit statt auf Qualität ihrer Zulassungen (a-t 4
[1998], 37),7 auch die FDA, die innerhalb von 9 Monaten drei Mittel vom Markt nehmen musste. Die Bedrohlichkeit von Interaktionen wird oft
unterschätzt, so etwa bei Sildenafil (VIAGRA; a-t 6 [1998], 53) oder Cisaprid (PROPULSIN u.a.; vgl. Seite 68). Wann wird sich wohl die Erkenntnis durchsetzen, dass Nutzen und Risiken von Arzneimitteln nicht durch
Marketingaktionen der Hersteller (POSICOR-Werbung: "optimierte Therapie"8) oder durch Meinungsbildner bestimmt werden, die neue
Wirkprinzipien unkritisch als Mittel der Wahl hinstellen (z.B. UNGER, T.: "Mibefradil ist sicher eine Verbesserung"9)? Empfehlungen sollten im
Sinne der evidence based medicine aus kontrollierten randomisierten Studien mit harten Endpunkten abgeleitet werden.
Das Kapitel Mibefradil könnte bald abgeschlossen sein, wenn nicht in Deutschland Asta Medica AWD das Lizenzpräparat CERATE über
Großhandlungen und Apotheken abverkaufen ließe. Im Schadensfall sieht sich der verordnende Arzt möglicherweise in Begründungsnot, warum
er bei dieser Konstellation Mibefradil weiter verordnet hat. Asta Medica klärt unzureichend über die Risiken auf, und das Bundesinstitut für
Arzneimittel und Medizinprodukte (BfArM) versäumt es, für zügige Schadensbegrenzung zu sorgen.
Die Schwäche der Überwachungsbehörde ist nicht nur Produkt ihrer mangelnden Kompetenz, sondern anscheinend auch im Sinne von Politik und
Gesetzgebung. Das Berliner Verwaltungsgericht stützt im jüngsten Entscheid zu Mikropillen vom Typ FEMOVAN/MARVELON - wie schon im Dezember
vergangenen Jahres - nicht die Bemühungen des Amtes um Verbraucherschutz, sondern einseitig Herstellerinteressen. Es akzeptiert nicht den wissenschaftlich
begründeten Verdacht auf Schädigung, der laut CONTERGAN-Einstellungsbeschluss zum Handeln zwingt, sondern verlangt den kausalen
Beweis.10 Maßnahmen zum Schutz von Patienten sind bei dieser Rechtsauslegung nach erfolgter Zulassung praktisch nicht mehr möglich (a-t 1 [1998], 1). Verbraucherschutz scheint sich nur noch durch Verweigerung einer Zulassung durchsetzen zu lassen.
Wie viele Tote werden wohl erforderlich sein, damit die europäische Behörde ihre unter dem Druck der Einführung in anderen Ländern
formulierte Zulassungsbereitschaft für Sildenafil überdenkt (Stand 1. Juli 1998: 30 Tote in Verbindung mit Sildenafil)?
In Industrienationen registrieren wir einen Trend zur raschen, aber laschen Arzneimittelzulassung, in Deutschland gepaart mit Blockierung und Versagen der
Aufsichtsbehörde bei der Risikoabwehr. Die Situation verschlechtert sich: Das Haftungsrecht im Arzneimittelgesetz wird nicht novelliert. Geschädigte
bleiben chancenlos. Für die Genehmigung klinischer Studien wird künftig das Votum einer - dem Sponsor geneigten - Ethikkommission genügen.
Kritische Kommissionen lassen sich so aushebeln.
Wir vermissen eine interne und externe Qualitätskontrolle bei nationalen und europäischen Zulassungen sowie die systematische wissenschaftliche
Fehleranalyse von Arzneimittelabstürzen, um die Strategie für künftige Zulassungen und Maßnahmen zur Risikoabwehr zu verbessern. Dazu
gehört auch die Analyse, warum Warnungen vor Risiken nicht hinreichend befolgt werden. Vielleicht haben Marketingabteilungen doch den längeren
Arm?
|

