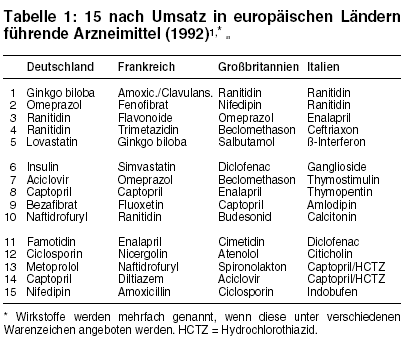
Ärzte europäischer Länder einigt die Vorliebe für regionale Besonderheiten, wenn sie zum Rezeptblock greifen. Nur sieben
Wirkstoffe finden sich sowohl in Frankreich, Großbritannien, Italien und Deutschland unter den jeweils 50 umsatzstärksten Arzneimitteln des Jahres 1992:
Das Virustatikum Aciclovir (ZOVIRAX u.a.), die ACE-Hemmer Captopril (LOPIRIN u.a.) und Enalapril (PRES u.a.), der Kalziumantagonist Nifedipin (ADALAT u.a.), die
Ulkusmittel Ranitidin (SOSTRIL u.a.) und Omeprazol (ANTRA u.a.) sowie der Lipidsenker Simvastatin (DENAN, ZOCOR).1 Kunterbunte Vielfalt
ohne Gemeinsamkeiten prägt die Restmärkte (vgl. Tabelle 1).
Ebenso wie der Krankheitswert von Beschwerden unterscheiden sich Diagnose und Therapiestandards von Land zu Land. Niedriger Blutdruck wird in Deutschland
häufiger ["erkannt" und] mit Medikamenten behandelt als etwa in angelsächsischen Ländern. Mit "Spasmophilie" bezeichnen
die Franzosen ein behandlungsbedürftiges Leiden im Verdauungstrakt, dessen therapeutischer Stellenwert bei uns geringer veranschlagt oder als vegetative
Dystonie ähnlich unpräzise umschrieben wird, verbrauchen dafür aber weniger Säurehemmer. Obskure Gangliosid-Präparate belegten in
Italien zu Lasten der Krankenkassen vordere Verordnungsrangplätze, weil dort offenbar die Impotenz des Mannes einen höheren Krankheitswert besitzt.
Weshalb Calcitonin und die Aminosäure L-Carnitin auf dem italienischen Pharmamarkt Spitzenstellungen einnehmen, läßt sich für
Nordländer schwer nachvollziehen. Inhalierbare Dosieraerosole für Asthmakranke dominieren den Handel mit Medikamenten in
Großbritannien.
Während Ärzte in Großbritannien durch rationale Arzneimittelauswahl die Finanzmittel in wirksame Therapie umsetzten, werde in Deutschland jede
achte DM verschwendet, folgert ein italienischer Pharmakologe aus den nationalen Arzneimittelhitlisten. Wenn Mediziner in Italien und Frankreich mit Vergeudung
jeder fünften Lira bzw. jedes fünften Franc noch schlechter abschneiden,1 so spricht das für noch größere Informationsdefizite.
Pflanzenextrakte und Ginkgo-biloba-Produkte (TEBONIN u.a.) sollen den "folkloristischen Einschlag" auf dem französischen und deutschen Markt
bilden. Auch Liponsäure (THIOCTACID u.a.) gilt als "merkwürdiger Bestseller" (vgl. a-t 3 [1994],
26).1 Kombinationspräparate stehen mit 10 der 50 Marktführer in Deutschland höher in der Gunst als in Frankreich (5), Italien (2) und
Großbritannien (1). Antibiotika fehlen in der deutschen Spitzengruppe, während in Frankreich und Großbritannien Amoxicillin (AMOXYPEN u.a.) bzw.
Amoxicillin plus Clavulansäure (AUGMENTAN) und in Italien die Cephalosporine Ceftriaxon (ROCEPHIN) und Ceftazidim (FORTUM) stärker verordnet
werden.

Eine Antibiotika-Therapie dauert in englischen Krankenhäusern durchschnittlich sechs, in Italien und Spanien etwa elf Tage. Eine Meningitis behandeln
englische Klinikärzte durchschnittlich nur etwa sechs, in Frankreich hingegen 24 Tage. Dafür muß der niedergelassene Arzt in England häufiger
als in anderen Ländern die in der Klinik begonnene Therapie fortsetzen.2
Die nationalen Verordnungsgewohnheiten beruhen auf kulturellen Unterschieden, Zeitströmungen und dem Werbedruck der Hersteller, werden aber auch
durch Arzneimittelgesetzgebung und Zulassungspraktiken der Behörden bestimmt. Ganglioside aus Rinderhirn (CRONASSIAL u.a.) gelangten in
Großbritannien und in den USA nie in den Handel, während sie in Deutschland 1989 wegen schwerer, zum Teil tödlicher GUILLAIN-BARRE-
Syndrome vom Markt genommen wurden (a-t 8 [1989], 76). In Italien nahmen sie bis zu ihrer Marktrücknahme im vergangenen Jahr vordere Rangplätze
ein.3 Wenn künftig die Wettbewerbskraft der europäischen Pharmabranche durch "schnellere und erleichterte" Zulassung von
Medikamenten in der europäischen Union gestärkt werden soll,4 werden die Folgeschäden unzureichender Prüfungen vor der
Zulassung von den Kranken zu tragen sein. Schon jetzt müssen in Deutschland und Frankreich auffällig oft neu zugelassene Arzneistoffe wegen
Unverträglichkeit vom Markt genommen werden – verglichen mit den USA.
Von 56 Arzneistoffen, die zwischen 1970 und 1992 aus dem Handel genommen wurden, waren 31 in Frankreich, 30 in Deutschland, 23 in Großbritannien, aber
nur 9 in den USA erhältlich. Mindestens 24 in Deutschland eingeführte und später wegen Unverträglichkeit zurückgezogene Arzneistoffe
blieben in den USA ohne Marktzutritt (Beispiele s. Tabelle 2). Umgekehrt stürzten in den USA in den 23 Jahren lediglich zwei Arzneimittel ab, die in Deutschland
keine Marktzulassung hatten – das Antiarrhythmikum Encainid und das nichtsteroidale Antirheumatikum Suprofen.3 Die strengeren
Zulassungsverfahren haben US-Bürgern im Vergleich zu Europäern wahrscheinlich zehntausende schwere Arzneimittelschäden und Todesfälle
erspart.3
Das Ergebnis hätte für die USA noch besser ausfallen können, wenn nicht die Arzneimittelaufsicht getäuscht worden wäre: Gerichte
befanden in den vergangenen Jahren drei Hersteller für schuldig, der US-amerikanischen Behörde zulassungsrelevante Daten über Todesfälle
oder schwere Schäden vorenthalten zu haben: Lilly für das Antirheumatikum Benoxaprofen (COXIGON; vgl. a-t 2 [1984], 19), SmithKline für das
Diuretikum Tienilsäure (SELACRYN) und Hoechst für das Antidepressivum Nomifensin (ALIVAL, in PSYTON; vgl. a-t 10 [1991], 93).3
FAZIT: Das strengere Zulassungsverfahren der USA bewahrt die Verbraucher – und die verordnenden Ärzte – relativ besser vor nutzlosen und
riskanten Arzneistoffen. In Europa scheinen Verordnungsgewohnheiten und Arzneimittelsicherheit eher einem Nord-Süd-Gefälle unterworfen zu sein. So
bleibt in Ländern wie Frankreich und Deutschland allzuoft nur die Notbremse: Arzneimittel müssen wegen lebensgefährlicher Schadwirkungen und
Todesfolge vorzeitig vom Markt genommen werden.
Eine Erleichterung der Arzneimittelzulassung im Zuge der europäischen Union kann den vorbeugenden Verbraucherschutz nur weiter schwächen.
Niedrigere Zulassungsanforderungen lassen sich in einer Ländervielfalt mit unterschiedlichen Zutrittsbarrieren leichter "harmonisieren" als selektive
Auswahlverfahren, die der "Folklore" zuwiderlaufen.
1 | Scrip 1995 (1995), 7 |
2 | McCONNEL, J.: Lancet 341 (1993), 1208 |
3 | WOLFE, S. M.: "Differences in the Number of Drug Safety Withdrawals – United
States, United Kingdom, Germany, France, 1970-1992", Manuskript vom 2. Febr. 1995 |
4 | BANGEMANN, M. zitiert nach Ärzteztg. vom 30. Jan. 1995 |
|


