ADJUVANTE AROMATASEHEMMER BEI BRUSTKREBS - AKTUELLER KENNTNISSTAND
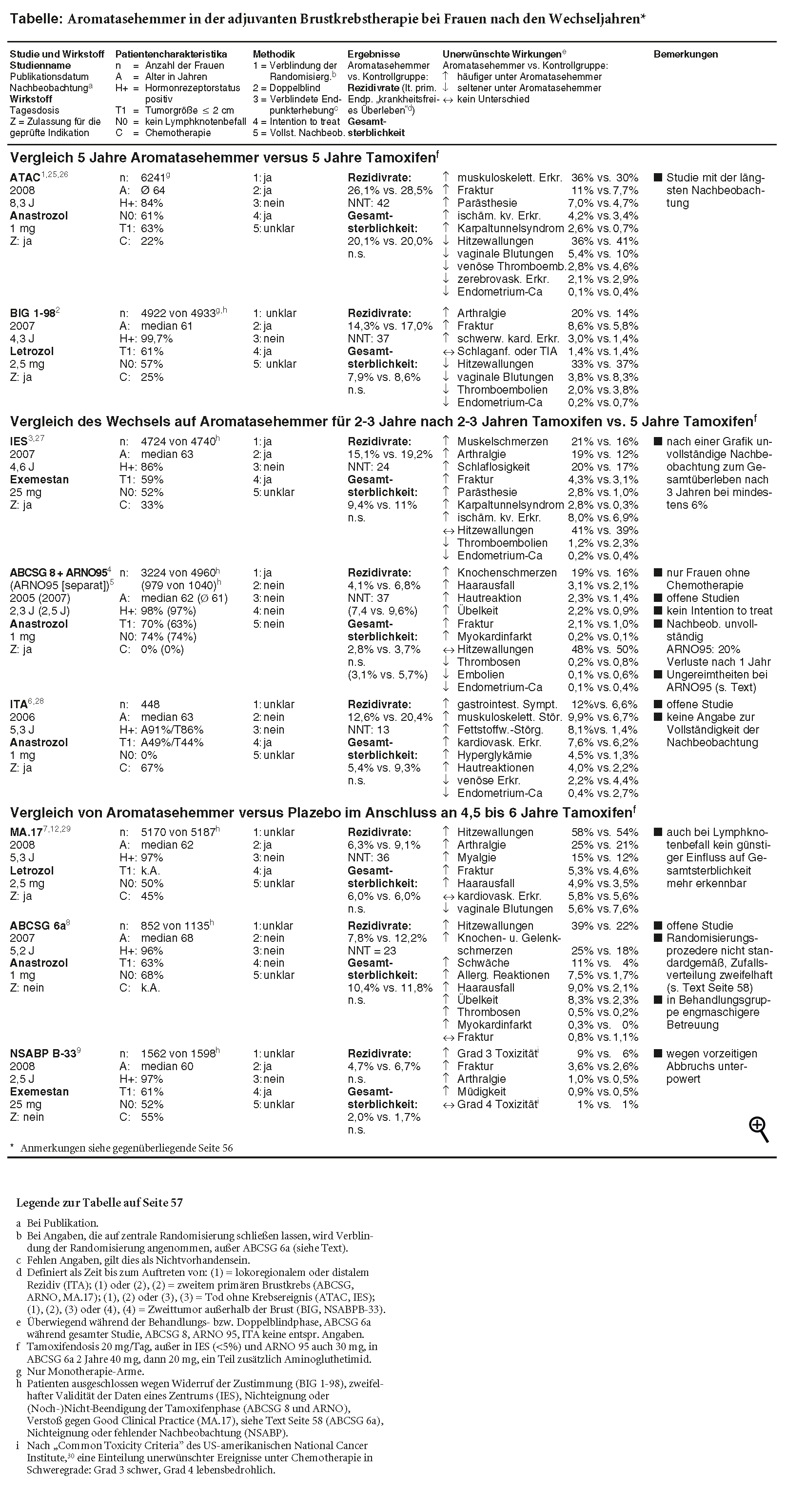
In den vorliegenden randomisierten kontrollierten Studien zur adjuvanten Brustkrebstherapie in der Postmenopause gehen Aromatasehemmer der dritten Generation im Vergleich zum Standardmittel Tamoxifen (NOLVADEX, Generika) konsistent mit einer geringfügig, aber (meist) signifikant verminderten Rezidivrate einher.1-9 Ein lebensverlängernder Nutzen der Mittel ist jedoch auch beim gegenwärtigen Stand der Nachbeobachtung für keine der drei geprüften Strategien - von Beginn an, Wechsel nach zwei bis drei Jahren Tamoxifen bzw. Anschlusstherapie nach fünf Jahren Tamoxifen - valide belegt (siehe Tabelle, Seite 57). Die einzelnen Studien sind auf diese Frage nicht ausgelegt und dürften auch nicht ausreichend dafür gepowert sein. Möglicherweise ist auch das bisherige Follow-up nach wie vor zu kurz, um eine Auswirkung auf die Gesamtsterblichkeit erkennen zu lassen. Der lebensverlängernde Effekt von Tamoxifen zeichnete sich in vollem Umfang erst nach mindestens zehnjähriger Nachbeobachtung ab. Die absolute Reduktion der Sterblichkeit durch fünfjährige Einnahme von Tamoxifen gegenüber Nichtbehandlung beträgt bei Frauen mit positivem oder unbekanntem Hormonrezeptorstatus nach 5 Jahren 3,5%, nach 10 Jahren 7,6% und nach 15 Jahren 7,9%. Die Rezidivrate nimmt bei diesen Frauen durch Tamoxifen nach 5 Jahren absolut um 11,4%, nach 10 Jahren um 13,6% und nach 15 Jahren um 11,8% ab.10
STUDIENLAGE: In der ATAC*-Studie, die Anastrozol (ARIMIDEX) als primäre adjuvante Therapie mit Tamoxifen vergleicht und von allen vorliegenden Studien die längste Nachbeobachtung hat, ist nach 8,3 Jahren kein Trend zu einer Reduktion der Sterblichkeit durch den Aromatasehemmer zu erkennen. In beiden Gruppen sind 20% der Frauen verstorben (vgl. Tabelle; a-t 2008; 39: 14-5).1 In der BIG*-Studie mit Letrozol (FEMARA) zeigt sich nach 4,3 Jahren eine nichtsignifikante Minderung der Sterblichkeit um 0,7%.2 In beiden Studien steht der geminderten Sterblichkeit unter dem Aromatasehemmer in der Subgruppe der Frauen mit Rezidiv eine numerisch höhere Sterblichkeit von Frauen ohne Rezidiv gegenüber. Spezifische, unter dem Aromatasehemmer häufigere Todesursachen sind dabei nicht zu sichern.
| * | ATAC = Arimidex, Tamoxifen Alone or in Combination; BIG = Breast International Group; |
Die Datenlage zur Wechsel- oder Sequenzstrategie wird dominiert von drei methodisch mangelhaften, offen durchgeführten Studien zu Anastrozol (ABCSG**-8-Studie, ARNO**-95-Studie und ITA**-Studie), von denen zwei 2005 als gepoolte Analyse veröffentlicht wurden.4 Eine vom Hersteller AstraZeneca gesponserte und unter seiner Beteiligung durchgeführte Metaanalyse aller drei Studien soll eine Senkung der Gesamtsterblichkeit durch den Aromatasehemmer belegen.11 Sie ist unseres Erachtens wegen Ausschluss von mehr als 25% der ursprünglich randomisierten Patientinnen und einer hohen Verlustrate in der Nachbeobachtung bei den übrigen Frauen nicht aussagekräftig (a-t 2006; 37: 121-2). Von der ABCSG-8-Studie finden wir keine vollständig publizierten aktualisierten Daten. Aus der ARNO-95-Studie wird zwei Jahre nach der gepoolten Analyse, aber mit dem alten Datenstand, eine gesonderte Auswertung veröffentlicht, in der eine (nominell) signifikante Senkung der Gesamtsterblichkeit im Anastrozolarm beschrieben wird.5 Neben Ungereimtheiten in den Angaben zum Zeitpunkt der Randomisierung und der Zahl der randomisierten bzw. ausgewerteten Teilnehmerinnen in den nunmehr vorliegenden drei Publikationen zu ARNO 95 fällt in dieser Studie eine hohe Verlustrate in der Nachbeobachtung auf, die bereits nach einem Jahr etwa 20% beträgt. Einen lebensverlängernden Nutzen von Anastrozol erachten wir auf der Basis dieser Daten als nicht valide belegt. In aktualisierten Auswertungen von IES**- und ITA-Studie bleibt die signifikant geminderte Rezidivrate unter Exemestan (AROMASIN) bzw. Anastrozol erhalten, ohne signifikanten Einfluss auf die Sterblichkeit.3,6 Die ITA-Studie fällt dadurch auf, dass sie als kleinste Untersuchung die größte Minderung der Rezidivrate zeigt.6
| ** | ABCSG = Austrian Breast and Colorectal Cancer Study Group; ARNO = Arimidex-Nolvadex; IES = Intergroup Exemestane Study; ITA = Italian Tamoxifen Anastrozole |
Zur Anschlusstherapie mit Aromatasehemmern nach fünfjähriger Tamoxifeneinnahme wurden zwei relevante neue Studien publiziert.8,9 An der NSABP***-B33-Studie mit Exemestan wird noch einmal deutlich, wie verhängnisvoll sich die vorzeitige Entblindung von Studien wegen Benefits, in diesem Fall der MA.***17-Studie mit Letrozol (a-t 2003; 34: 99-100), auf den medizinischen Kenntnisstand auswirkt. Nach Bekanntwerden der Zwischenanalyse der MA.-17-Studie wurde die NSABP-B33-Studie ebenfalls vorzeitig gestoppt. Zu diesem Zeitpunkt war jedoch erst gut die Hälfte der geplanten Studienteilnehmerinnen aufgenommen worden. Für das als primären Endpunkt definierte krankheitsfreie Überleben ergibt sich in der Studie nur ein Trend (Rezidivrate 4,7% vs. 6,7% unter Plazebo; p = 0,07). Die Gesamtsterblichkeit unterscheidet sich bei sehr kleinen Zahlen nicht signifikant.9
| *** | MA = keine Erläuterung auffindbar NSABP = National Surgical Adjuvant Breast and Bowel Project |
Auch der Erkenntnisgewinn aus der MA.-17-Studie selbst wird voraussichtlich begrenzt bleiben. Nach der vorzeitigen Entblindung nach zweieinhalbjähriger Anschlusstherapie wurde der Plazebogruppe ebenfalls Letrozol angeboten, wovon 66% der Frauen, die bis dahin kein Rezidiv entwickelt hatten, Gebrauch machten. Laut aktualisierten Daten bleibt die geminderte Rezidivrate unter Letrozol nach 5,3 Jahren erhalten. Die Gesamtsterblichkeit unterscheidet sich mit 6% in beiden Gruppen nicht.7 Inwieweit dies auf einem "Verdünnungseffekt" durch das hohe Crossover beruht, wird sich vermutlich nicht mehr klären lassen. Auch in der Subgruppe der Frauen mit Lymphknotenbefall ist anders als in einer früheren Auswertung (a-t 2006; 37: 19-21)12 kein günstiger Einfluss des Aromatasehemmers auf die Sterblichkeit mehr erkennbar.7 Bei dem damaligen Subgruppenbefund dürfte es sich am ehesten um eine zufällige Schwankung gehandelt haben: Eine signifikante Interaktion zwischen den Subgruppen mit und ohne Lymphknotenbefall und der Therapie im Hinblick auf die Sterblichkeit gab es auch damals nicht (a-t 2006; 37: 19-21).13
Die zweite neue Studie zu dieser Strategie, die offene ABCSG-6a-Studie,8 hat erhebliche Qualitätsmängel. Sie ist Folgestudie eines Vergleichs der adjuvanten Tamoxifentherapie mit einer adjuvanten Kombination aus Tamoxifen und dem nicht mehr im Handel befindlichen Aromatasehemmer Aminoglutethimid (früher: ORIMETEN u.a.). Mit 852 Patientinnen ist sie für eine ausreichende Trennschärfe (Power) nicht nur viel zu klein. Durch ein Randomisierungsprozedere, in dem die Frauen randomisiert wurden, bevor sie ihr Einverständnis gegeben hatten, wurde zudem eine schiefe Verteilung auf die beiden Vergleichsgruppen erzeugt: In der Anastrozolgruppe haben mit 170 deutlich mehr Frauen ihr Einverständnis verweigert als in der Kontrollgruppe ohne Anschlusstherapie (105).8 Es ist daher unseres Erachtens zweifelhaft, ob bei den so entstandenen Vergleichsgruppen überhaupt noch von Zufallsverteilung gesprochen werden kann.
Das Störwirkungsprofil der Aromatasehemmer unterscheidet sich von dem von Tamoxifen zum einen durch seltenere Thromboembolien und Endometriumkarzinome. Das Frakturrisiko nimmt andererseits unter Aromatasehemmern zu, möglicherweise auch das Risiko kardiovaskulärer Komplikationen.14 Auch Muskel- und Gelenkbeschwerden scheinen häufiger vorzukommen als unter Tamoxifen.
LEITLINIENEMPFEHLUNGEN: Empfehlungen zur adjuvanten hormonellen Therapie in der Postmenopause variieren. Die Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) rät 2009 mit hohem Empfehlungsgrad sowohl zur fünfjährigen Behandlung mit einem Aromatasehemmer oder zur fünfjährigen Sequenztherapie als auch zur fünfjährigen Behandlung mit Tamoxifen. Betont wird jedoch, dass primär und sequenziell verwendete Aromatasehemmer im Hinblick auf das krankheitsfreie Überleben überlegen sind. Die Anschlusstherapie mit Aromatasehemmer wird mit höchstem Empfehlungsgrad nur bei Lymphknotenbefall angeraten.15 Die S3-Leitlinie der Deutschen Krebsgesellschaft stellt die Überlegenheit adjuvanter Aromatasehemmer generell heraus und empfiehlt alle drei Behandlungsstrategien mit diesen Mitteln. Die fünfjährige Tamoxifeneinnahme wird ausschließlich für Niedrigrisikopatientinnen empfohlen.16 Auch das britische NICE**** bevorzugt Aromatasehemmer für Frauen, die nicht zur Niedrigrisikogruppe (10-Jahres-Überlebenswahrscheinlichkeit mindestens 93%) gehören.17 In kanadischen Leitlinien von 2008 werden Tamoxifen als akzeptable Option und Aromatasehemmer als akzeptable Alternative empfohlen.18
| **** | NICE = National Institute for Health and Clinical Excellence |
OFFENE FRAGEN: Neben der offenen Frage, ob sich adjuvant eingenommene Aromastasehemmer im Vergleich zu Tamoxifen langfristig günstig auf die Sterblichkeit auswirken werden, ist bis heute ebenfalls ungeklärt, welches die optimale endokrine Therapie für Frauen ist, die ein Rezidiv erleiden, nachdem sie adjuvant Aromatasehemmer eingenommen haben.16,19 Für Frauen mit Rezidiv während oder nach adjuvanter Tamoxifeneinnahme gibt es dagegen mit Aromatasehemmern oder auch - bei länger als ein Jahr zurückliegender Einnahme - erneutem Tamoxifen etablierte Therapieoptionen.20
Eine weitere offene Frage betrifft Tamoxifen. Das Antiöstrogen unterliegt einer vielfältigen Verstoffwechselung, an der verschiedene CYP-Enzyme beteiligt sind und bei der sowohl aktive als auch inaktive Metaboliten entstehen, darunter das so genannte Endoxifen, das eine nahezu hundertfach höhere Affinität zum Östrogenrezeptor hat als die Muttersubstanz. Endoxifen gilt als ein für die therapeutische Wirksamkeit von Tamoxifen relevanter aktiver Metabolit. Nach verschiedenen klinischen Studien scheint CYP 2D6 eine wichtige Rolle für die Bildung von Endoxifen zu spielen. So sinken die Spiegel bei Komedikation mit potenten CYP-2D6-Hemmern wie Paroxetin (SEROXAT, Generika). Auch so genannte langsame Metabolisierer, Träger von Genvarianten mit abgeschwächter oder fehlender CYP-2D6-Aktivität, haben danach geringere Endoxifenspiegel. Ob bei verringerter CYP-2D6-Aktivität auch der Erfolg einer Tamoxifentherapie gemindert ist, ist derzeit aber unklar: Die dazu vorliegenden Studien sind klein, überwiegend retrospektiv und in ihren Ergebnissen nicht konsistent.21 Anders als es die Selbsthilfegruppe mamazone darstellt, die vom Testanbieter Roche jährlich mehr als 40.000 € erhält22 und die den Frauen nahelegt, sich auf ihren CYP-2D6-Genotyp hin testen zu lassen,23 schätzen führende Experten auf diesem Gebiet die Datenlage derzeit als wenig gesichert ein.24 Von einer routinemäßigen Testung raten sie ab.21
KOSTEN: Alle drei Aromatasehemmer werden zu über 600 € für 100 Tabletten in den zugelassenen Dosierungen angeboten, Anastrozol (ARIMIDEX) und Exemestan (AROMASIN) zu 606,77 €, Letrozol (FEMARA) zu 603,96 €. Ein günstiges Tamoxifengenerikum (z.B. TAMOXIFEN AL) kostet dagegen 21,42 € pro 100 Tabletten zu 20 mg. Die Aromatasehemmer verteuern die adjuvante Therapie daher auf das 28fache. Für die Verhinderung eines Rezidivs durch einen primär statt Tamoxifen verordneten, fünf Jahre lang eingenommenen Aromatasehemmer (NNT = 37 bzw. 42) müssen 400.000 € bis 450.000 € aufgewendet werden.
In der adjuvanten hormonellen Therapie des Brustkrebses bei Frauen in der Postmenopause senken Aromatasehemmer der dritten Generation im Vergleich mit dem Antiöstrogen Tamoxifen (NOLVADEX, Generika) die Rezidivrate geringfügig.
Ein günstiger Effekt der Aromatasehemmer auf die Sterblichkeit ist nicht belegt.
Das Störwirkungsprofil der Aromatasehemmer unterscheidet sich von dem von Tamoxifen durch häufigere Frakturen, möglicherweise auch durch häufigere kardiovaskuläre Komplikationen, aber weniger Thromboembolien und Endometriumkarzinome.
Die optimale endokrine Therapie für Frauen mit Rezidiv nach adjuvanter Einnahme von Aromatasehemmern ist derzeit unklar.
Für die Verhinderung eines Rezidivs durch einen primär statt Tamoxifen verordneten Aromatasehemmer sind 400.000 € bis 450.000 € aufzuwenden.
Tamoxifen ist unseres Erachtens nach wie vor Mittel der Wahl in der adjuvanten Brustkrebstherapie.
| (R = randomisierte Studie, M = Metaanalyse) | ||
| R | 1 | The Arimidex, Tamoxifen, Alone or in Combination Trialists' Group: Lancet Oncol. 2008; 9: 45-53 |
| R | 2 | COATES, A.S. et al.: J. Clin. Oncol. 2007; 25: 486-92 |
| R | 3 | COOMBES, R.C. et al.: Lancet 2007; 369: 559-70 |
| R | 4 | JAKESZ, R. et al.: Lancet 2005; 366: 455-62 |
| R | 5 | KAUFMANN, M. et al.: J. Clin. Oncol. 2007; 25: 2664-70 |
| R | 6 | BOCCARDO, F. et al.: Ann. Oncol. 2006; 17 (Suppl. 7): VII 10-VII 14 |
| R | 7 | INGLE, J.N. et al.: Ann. Oncol. 2008; 19: 877-82 |
| R | 8 | JAKESZ, R. et al.: J. Natl. Cancer Inst. 2007; 99: 1845-53 |
| R | 9 | MAMOUNAS, E.P. et al.: J. Clin. Oncol. 2008; 26: 1965-71 |
| M | 10 | Early Breast Cancer Trialists' Collaborative Group: Lancet 2005; 365: 1687-1717 |
| M | 11 | JONAT, W. et al.: Lancet Oncol. 2006; 7: 991-6 |
| R | 12 | GOSS, P.E. et al.: J. Natl. Cancer Inst. 2005; 97: 1262-71 |
| 13 | TU, D.: Schreiben vom 23. April 2009 | |
| M | 14 | CUPPONE, F. et al.: Cancer 2008; 112: 260-7 |
| 15 | Arbeitsgemeinschaft Gynäkologische Onkologie (AGO): Adjuvant Endocrine Therapy Postmenopausal Patients, 21. Mai 2009 http://www.ago-online.de/_download/unprotected/g_mamma_09_1_0_02_adj_endo_therapy_postmenopausal_patients.pdf | |
| 16 | Deutsche Krebsgesellschaft e.V. et al.: Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms, 2008 http://www.krebsgesellschaft.de/download/interdiszipl._s3-ll_mamma_080211.pdf | |
| 17 | National Institute for Health and Clinical Excellence: Early and locally advanced breast cancer. Diagnosis and treatment, Febr. 2009 http://www.nice.org.uk/nicemedia/pdf/CG80NICEGuideline.pdf | |
| 18 | EISEN, A. et al.: The Role of Aromatase Inhibitors in Adjuvant Therapy for Postmenopausal Women with Hormone Receptor-positive Breast Cancer: Guideline Recommendations, 26. Feb. 2008 http://www.cancercare.on.ca/pdf/pebc1-18f.pdf | |
| 19 | National Institute for Health and Clinical Excellence: Advanced breast cancer: diagnosis and treatment, Feb. 2009 http://www.nice.org.uk/nicemedia/pdf/CG81FullGuideline.pdf | |
| 20 | CARLSON, R.W. et al.: J. Natl. Compr. Canc. Netw. 2009; 7: 122-92 | |
| 21 | HIGGINS, M.J. et al.: J. Natl. Compr. Canc. Netw. 2009; 7: 203-13 | |
| 22 | BONSTEIN, J.: Spiegel 2008; Nr. 17: 98-102 | |
| 23 | GOLDMANN-POSCH, U.: "Welcher CYP 2D6-Typ sind Sie?", mamazone, ohne Datum; http://www.mamazone.de/publikationen/medizinische-informationen/cyp2d6-typ0/ | |
| 24 | SINHA, G.: J. Natl. Cancer Inst. 2008; 100: 1050-1 | |
| R | 25 | ATAC Trialists' Group: Lancet 2002; 359: 2131-39 |
| R | 26 | ATAC Trialists' Group: Lancet Oncol. 2006; 7: 633-43 |
| 27 | Pfizer (USA): Product information AROMASIN, Stand Okt. 2008 | |
| R | 28 | BOCCARDO, F. et al.: J. Clin. Oncol. 2005; 23: 5138-47 |
| R | 29 | GOSS, P.E. et al.: N. Engl. J. Med. 2003; 349: 1793-802 |
| 30 | MAMOUNAS, E.P.: Schreiben vom 9. Juni 2009 |
© 2009 arznei-telegramm, publiziert am 12. Juni 2009
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.