SCREENING AUF ZERVIXKARZINOM
...Informationen zur Beratung von Frauen
Ingrid MÜHLHAUSER, Melanie FILZ*
| * | Universität Hamburg MIN Fakultät, Gesundheitswissenschaften Martin-Luther-King-Platz 6 D-20146 Hamburg E-Mail: Ingrid_Muehlhauser@uni-hamburg.de |
Beratungspflicht
Zum 1. April 2007 ist das GKV-Wettbewerbsstärkungsgesetz in Kraft getreten. Es sah ursprünglich vor, gesetzlich Krankenversicherte zur Teilnahme an bestimmten Gesundheitsuntersuchungen zu verpflichten. Der Gemeinsame Bundesausschuss (G-BA) hat hierfür die wissenschaftliche Grundlage geprüft. Er kam zu dem Schluss, dass selbst für wirksame Krebsfrüherkennungsprogramme ein Zwang zur Teilnahme nicht vertretbar wäre. Die Teilnahmepflicht wurde zu einer Beratungspflicht abgeschwächt. Diese betrifft zunächst die Früherkennung von Brustkrebs, Darmkrebs und Gebärmutterhalskrebs.1 Wird die Beratung nicht in Anspruch genommen, verlieren die Versicherten im Krankheitsfall die finanziellen Vorteile für chronisch Erkrankte. Sie müssen sich dann mit zwei statt mit maximal einem Prozent der jährlichen Bruttoeinkünfte an den Zuzahlungen für medizinische Leistungen beteiligen. Die Regelung gilt für Versicherte, die vom 1. Januar 2008 an erstmals Vorsorgeuntersuchungen nach § 25 des V. Sozialgesetzbuches (SGB V) in Anspruch nehmen können. Das sind alle Frauen, die nach dem 1. April 1987, und alle Männer, die nach dem 1. April 1962 geboren wurden. Die Beratung soll durch jene Ärztinnen und Ärzte ("Leistungsanbieter") erfolgen, die die Früherkennungsuntersuchungen durchführen.
Pflicht zur umfassenden/ausgewogenen Beratung
Inhalt und Art der Beratung sind nicht definiert. Üblicherweise sind Informationsmaterialien und Beratungen zu Vorsorgeuntersuchungen kampagnen- und interessengeleitet, überredend, unausgewogen und irreführend.2-4 International wurden jedoch ethische Leitlinien und wissenschaftliche Kriterien definiert, wie eine Beratung von Gesunden über Früherkennungsuntersuchungen erfolgen sollte.5-7
Der Nutzen von Krebsfrüherkennungsmaßnahmen ist meist gering. Dem steht ein nicht unerheblicher möglicher Schaden für das Individuum gegenüber.8,9 Aus diesem Grund muss den potenziellen Teilnehmern eine so genannte informierte Entscheidung möglich sein. Diese sieht ausdrücklich auch ein Abstandnehmen von den Untersuchungen vor.
Voraussetzung sind evidenzbasierte, umfassende Informationen, die in einer ausgewogenen Art und Weise den möglichen Nutzen und Schaden der Vorsorgemaßnahmen darstellen. Solche Informationen stehen inzwischen für das Mammographie-Screening10,11 und das Darmkrebs-Screening12 zur Verfügung. Für das Screening auf Zervixkarzinom fehlen hingegen entsprechend aufgearbeitete Materialien. Der vorliegende Artikel möchte Informationen für eine Beratung bereitstellen, als Grundlage für eine informierte Entscheidung der Frauen.
Besonderheiten des Zervixkarzinom-Screenings
Das Screening auf Zervixkarzinom wird weithin und so gut wie unwidersprochen als das Vorzeigebeispiel für erfolgreiche Krebsfrüherkennung gepriesen und propagiert. Nichts desto trotz gibt es gerade für das Screening auf Zervixkarzinom erhebliche Wissenslücken. Im Gegensatz zum Mammographie-Screening und zum Darmkrebs-Screening mit Okkultbluttest wurde das Screening auf Zervixkarzinom niemals durch randomisierte kontrollierte Studien untersucht. Daher ist die Bewertung des Nutzen-Schaden-Verhältnisses mit großen Unsicherheiten verbunden. Die enge Assoziation zwischen Zervixkarzinom und Infektionen mit humanen Papillomaviren (HPV) und die Verfügbarkeit einer Impfung (vgl. a-t 2007; 38: 57-9 und 101-3) stellen zudem eine Primärprävention des Zervixkarzinoms in Aussicht. Eine Bewertung des Screenings auf Zervixkarzinom kann nur unter Berücksichtigung dieser beiden Aspekte erfolgen.
Bewertung von Screeningprogrammen
Die Bewertung von Screeningprogrammen erfolgt international nach Kriterien, die erstmals 1968 durch die WHO publiziert wurden.13 Diese Kriterien werden heute in aktualisierter Fassung weltweit benutzt.14,15 Sie beziehen sich auf die Erkrankung, den Screeningtest, die Behandlungsoptionen und das gesamte Programm zur Implementierung des Screenings in ein Gesundheitssystem. Die vorliegende Ausarbeitung orientiert sich an diesen Screeningkriterien.
Die Darstellung stützt sich auf eine zuletzt Anfang 2008 aktualisierte Literaturrecherche. Vorrangig werden, soweit verfügbar, HTA**-Berichte des DIMDI***, Cochrane Reviews und andere systematische Übersichtsarbeiten benutzt. Zusätzlich werden insbesondere zur Bewertung unerwünschter Wirkungen des Screenings ausgewählte Originalarbeiten herangezogen. Zur Beurteilung der spezifischen bundesdeutschen Bedingungen werden auch die themenbezogenen Berichte des G-BA und andere Artikel einschließlich so genannter grauer Literatur sowie Daten der Techniker Krankenkasse benutzt.
| ** | HTA = Health Technology Assessment, systematische Bewertung medizinischer Verfahren und Technologien, die einen Bezug zur gesundheitlichen Versorgung der Bevölkerung haben |
| *** | DIMDI = Deutsches Institut für Medizinische Dokumentation und Information |
Zur Bedeutung der Erkrankung Zervixkarzinom
EIN WICHTIGES GESUNDHEITSPROBLEM? Von 100.000 Frauen, die in Deutschland leben, erkranken pro Jahr ungefähr 500 Frauen an irgendeiner Krebserkrankung, davon 15 Frauen an Zervixkarzinom, 85 an Darmkrebs und 135 an Brustkrebs. Bezogen auf die Gesamtheit der etwa 42.000.000 Frauen in Deutschland erkranken pro Jahr etwa 200.000 Frauen an irgendeiner Krebserkrankung, davon ungefähr 6.200 an Zervixkarzinom, 36.000 an Darmkrebs und 57.000 an Brustkrebs.16
Von 100.000 Frauen, die in Deutschland leben, sterben pro Jahr ungefähr 230 Frauen an irgendeiner Krebserkrankung, davon 3 an Zervixkarzinom, 30 an Darmkrebs und 40 an Brustkrebs. An einer Krankheit des Kreislaufsystems sterben 480 Frauen.17 Bezogen auf die Gesamtheit der etwa 42.000.000 Frauen in Deutschland sterben also pro Jahr ungefähr 100.000 Frauen an irgendeiner Krebserkrankung, davon 1.500 an Zervixkarzinom, 13.500 an Darmkrebs und 17.000 an Brustkrebs. An einer Krankheit des Kreislaufsystems sterben 210.000 Frauen.17
Das Lebenszeitrisiko, an Zervixkarzinom zu erkranken und zu versterben, hängt vom aktuellen Alter und der restlichen Lebenserwartung ab (Tabelle 1). Mit zunehmendem Alter sinkt das Risiko. Auch ein schlechter Gesundheitszustand, der die Lebenserwartung verkürzt, verringert die Wahrscheinlichkeit, an einem Zervixkarzinom zu sterben.18
Durchschnittlich 70% der Frauen, bei denen ein invasives Zervixkarzinom diagnostiziert wird, überleben das Zervixkarzinom mindestens 5 Jahre und 60% 10 Jahre.19
Unter den aktuellen Screening-Bedingungen in Deutschland dürften etwa 1.000 von 100.000 Frauen (oder 10 von 1.000) im Laufe ihres Lebens an einem Zervixkarzinom erkranken, 300 (oder 3 von 1.000) daran versterben. Nach Modellrechnungen sollen "ohne Screening" über die Lebenszeit 3.000 von 100.000 (oder 30 von 1.000) Frauen an einem Zervixkarzinom erkranken und 1.000 von 100.000 (oder 10 von 1.000) daran sterben. Pro Jahr würden nach diesen Modellrechnungen ‚ohne Screening' etwa 40 von 100.000 Frauen an einem invasiven Zervixkarzinom erkranken. 21,22****
| **** | Die Bezugsgröße in den Modellrechnungen ist nicht die gesamte weibliche Population. Frauen nach Hysterektomie werden ausgeschlossen, wobei eine Hysterektomierate von 30 pro 100 Frauen bis zum Lebensende zugrunde gelegt wird. Dies ist für Angaben aus den Krebsregistern nicht der Fall. Die Schätzwerte für "ohne Screening" sind daher vergleichsweise hoch. Der Nutzen des Screenings wird somit eher zu hoch geschätzt. |
EPIDEMIOLOGIE UND KRANKHEITSVERLAUF GEKLÄRT? Ein Zusammenhang zwischen HPV-Infektion und Zervixkarzinom ist heute gesichert. Ohne HPV-Infektion scheint es kein Zervixkarzinom zu geben. Umgekehrt führt eine HPV-Infektion aber nur selten zu einem Zervixkarzinom. Voraussetzung ist eine Persistenz der Infektion, also eine chronische Entzündung. Jedoch entwickelt sich auch dann nur selten ein Zervixkarzinom.
Mehr als 100 Genotypen des humanen Papillomavirus, einem DNA-Virus aus der Familie der Papovaviren, sind heute bekannt. Davon sind mehr als 20 für den menschlichen Anogenitaltrakt infektiös, 13 bis 18 werden mit dem Zervixkarzinom in Verbindung gebracht.23,24 Gemäß ihrer Assoziation mit zervikalen intraepithelialen Dysplasien (sog. CIN, siehe Seite 31) bis hin zum Zervixkarzinom werden Niedrigrisiko- und Hochrisiko-Genotypen unterschieden. HPV 16 und 18 sind als Hochrisikotypen des Virus mit 70% der Zervixkarzinome und 50% der schweren Dysplasien (CIN 3+) assoziiert. Andere wie HPV 45, 31, 33, 52 und 58 finden sich bei etwa 20% dieser Veränderungen. HPV 6 und 11 sind mit 90% der Genitalwarzen assoziiert.23
Ein Zervixkarzinom entwickelt sich in vier Stufen: 1. HPV-Infektion, 2. Viruspersistenz, 3. Progression einer persistierend infizierten Zelllinie zu Krebsvorstufen, 4. Entwicklung zu einem invasiven Karzinom.
Der Zeitraum zwischen Infektion und Zervixkarzinom wird auf 15 bis 30 Jahre geschätzt, die minimale Latenzzeit auf 8 Jahre.25 Dabei ist der Entwicklungszeitraum von der Infektion bis zur Präkanzerose mit etwa 10 Jahren kürzer als jener zwischen Präkanzerose und invasivem Karzinom, der in der Regel mehr als 10 Jahre betragen soll.23
Tabelle 1: Geschätztes Erkrankungs- und Sterberisiko bis zum 90. Lebensjahr in Abhängigkeit vom aktuellen Lebensalter.16,18-20 Zervix- im Vergleich zu Brustkrebs (Anzahl pro 1.000 Frauen der jeweiligen Altersgruppe)


Auch wenn eine HPV-Infektion Voraussetzung für ein Zervixkarzinom ist, müssen für die Entwicklung zum invasiven Karzinom noch andere Risikofaktoren eine Rolle spielen. Progredienz erfolgt nur bei einem kleinen Teil der infizierten Frauen. Rückbildung der Zellveränderungen und Ausheilung der Infektion sind in jedem Stadium möglich. Es werden Risikofaktoren für die Infektion, die Entwicklung von Präkanzerosen und die Progression zum Zervixkarzinom unterschieden:
Infektion: Der häufigste Übertragungsweg für HPV sind sexuelle Kontakte, sodass fast alle sexuell aktiven Menschen im Laufe ihres Lebens HPV-Infektionen durchmachen.20 In 20% bis 30% der Infektionsfälle werden mehrere HPV-Typen gleichzeitig übertragen.23 Bei nur 50% bis 60% der natürlichen Infektionen entwickeln sich Antikörper.24 Bei nur etwa 30% der infizierten Frauen lassen sich zytologisch Zellveränderungen nachweisen.23 Infektionsraten variieren erheblich zwischen Ländern. Mit zunehmendem Alter nimmt die Infektionsrate ab. Bei US-amerikanischen Frauen im Alter zwischen 20 und 25 Jahren wurde in Zervixabstrichen HPV-DNA bei 20% bis 50% nachgewiesen, nach dem 50. Lebensjahr noch bei 20% der Frauen.23,26 Allerdings wurden die Hochrisikotypen HPV 16 und 18 nur bei etwa 1% der Frauen gefunden.26 Für Deutschland werden vergleichsweise niedrige Infektionsraten berichtet. Die Prävalenz soll für jüngere Frauen 15% bis 20%, ab dem 30. Lebensjahr maximal 8% betragen.25 Aus unterschiedlichen Infektionsraten lassen sich keine Schlüsse auf Verlauf und Prognose der Infektionen ableiten.27
Männer entwickeln ebenfalls Genitalwarzen, jedoch seltener als Frauen. Homosexuelle Männer zeigen erhöhte Raten an analen HPV-Infektionen und ein erhöhtes Risiko für Analkarzinome.24
Regelmäßige Nutzung von Kondomen durch männliche Partner reduziert die Infektionsrate.28,29 Pro 100 Studentinnen, deren erste Sexualpartner immer Kondome benutzten, war nach 8 Monaten bei etwa 40 eine HPV-Infektion nachweisbar. Im Vergleich dazu war das bei etwa 90 pro 100 Frauen der Fall, deren Sexualpartner nur selten oder gar keine Kondome verwendeten. Auch Zellveränderungen an der Zervix waren bei Kondomgebrauch seltener nachweisbar: keine, wenn immer Kondome benutzt wurden, im Vergleich zu etwa 14 pro 100 Frauen bei seltenem Kondomgebrauch.29 Völliger Schutz scheint nicht möglich zu sein, da die Viren ein hohes Infektionspotenzial besitzen und auch durch Schmierinfektionen, z.B. bei gynäkologischen Untersuchungen, übertragen werden können. Mehr als 80% der HPV-Infektionen heilen durch zelluläre Immunität innerhalb von zwei Jahren aus und mehr als 90% innerhalb von drei Jahren.23
Persistenz, Regression, Progredienz: Es gibt keine allgemeingültige Definition für die Persistenz einer HPV-Infektion. Häufig wird eine solche angenommen, wenn die Infektion nach zwei Jahren nicht ausgeheilt ist.23 Gründe für die Chronifizierung einer HPV-Infektion sind unklar, ebenso die Faktoren für eine Entwicklung von Präkanzerosen bzw. der Progression zu einem invasiven Karzinom.
Als stärkster Risikofaktor gilt der Virustyp und hier insbesondere HPV 16. Bei Persistenz einer Infektion mit diesem Virustyp zeigen nach drei bis fünf Jahren etwa 40% der Frauen Präkanzerosen.23 Als weitere Risikofaktoren gelten Infektionen mit mehreren HPV-Typen, hohe Viruslast und Immunsuppression zum Beispiel bei HIV-Infektion. Darüber hinaus werden unter anderem Rauchen und Einnahme der Pille mit erhöhtem Zervixkarzinomrisiko in Verbindung gebracht.23,24
Aufgrund von Kohortenanalysen wird geschätzt, dass die Einnahme der Pille über zehn Jahre im Alter von etwa 20 bis 30 Jahren das Risiko für ein Zervixkarzinom bis zum 50. Lebensjahr von etwa 3,8 auf 4,5 pro 1.000 Frauen erhöht. Nach Absetzen der Pille normalisiert sich das Risiko wieder.30
Die konsequente Nutzung von Kondomen scheint sowohl die Ausheilung einer HPV-Infektion zu begünstigen als auch die Rückbildung von Zellveränderungen zu beschleunigen. In einer randomisierten kontrollierten Studie mit Frauen, die Zellveränderungen hatten, war Kondomgebrauch mit einer höheren Rückbildungsrate der Zellveränderungen und mit einer rascheren Ausheilung der HPV-Infektion assoziiert. Nach zwei Jahren waren bei 53 pro 100 Frauen mit Kondomgebrauch die Zellveränderungen verschwunden und bei 23 pro 100 Frauen die Infektion nicht mehr nachweisbar. Im Vergleich dazu war dies nur bei 35 pro 100 Frauen (Zellveränderungen) bzw. 4 pro 100 Frauen (Ausheilung der Infektion) der Fall, wenn keine Kondome benutzt worden waren.31
Beschneidung der Männer scheint nicht vor HPV-Infektion zu schützen, jedoch entwickeln Frauen von beschnittenen Männern seltener Präkanzerosen oder invasive Zervixkarzinome.32 Inwieweit diese Assoziation kausal bedingt ist, bleibt offen.
KLAR DEFINIERTES UND DIAGNOSTIZIERBARES FRÜHSTADIUM? Das Zervixkarzinom entwickelt sich typischerweise an der Transformationszone der Zervix, dem Übergang des Plattenepithels der Ektozervix zum Zylinderepithel der Endozervix. Diese Umwandlungszone ist individuell unterschiedlich und liegt bei jungen Frauen eher im Ektozervixbereich, während sie mit zunehmendem Alter eher endozervikal liegt und daher schlechter zugängig ist. Wenn Populationen nicht gescreent sind, finden sich fast ausschließlich Plattenepithelkarzinome. Bei hoher Screeningrate beträgt der Anteil an Adenokarzinomen 15% bis 20%.23
Die Prävention von Zervixkarzinomen nach einem auffälligen Screeningbefund beruht auf einer Destruktion bzw. Exzision der gesamten Transformationszone, nicht nur der spezifischen präkanzerösen Anteile. Diese Vorgehensweise ist in 80% bis 95% aller Fälle effektiv.23 Der lange Zeitraum zwischen Entwicklung einer Präkanzerose und Progression zu einem invasiven Karzinom bietet prinzipiell eine ideale Situation für ein Screening. Das Problem ist die schwierige prognostische Differenzierung der Zellveränderungen. Viele vermeintliche Präkanzerosen werden behandelt, obwohl sie sich auch ohne Behandlung zurückbilden oder nicht zu einem invasiven Karzinom fortschreiten würden.
Die zervikalen intraepithelialen Dysplasien (syn. Cervikale Intraepitheliale Neoplasie = CIN) werden in drei Schweregrade eingeteilt:
CIN 1: Geringgradige Dysplasie.
CIN 2: Mäßiggradige Dysplasie.
CIN 3: Hochgradie Dysplasie und Carcinoma in situ (CIS).
Häufigkeit der Zellveränderungen: Abbildung 1 zeigt Schätzungen für die Häufigkeit intraepithelialer Dysplasien für Deutschland ohne Screening nach Modellrechnungen.22
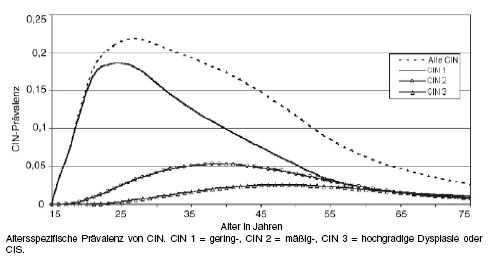
Abbildung 1: Verteilung geschätzter Häufigkeiten der unterschiedlichen Schweregrade von Dysplasien bei Frauen in Deutschland in Abhängigkeit vom Alter, unter der Annahme, dass es kein Screening gäbe (Abbildung übernommen aus22).
Die mittlere Gesamtprävalenz (über alle Altersgruppen ab dem 15. Lebensjahr unter Ausschluss des Anteils der Frauen nach Hysterektomie) für CIN 1 bis 3 einschließlich Carcinoma in situ wird nach diesen Modellrechnungen auf 7,2% geschätzt. Das heißt, etwa sieben von 100 Frauen hätten irgendwelche Zellveränderungen an der Zervix. Der Altersgipfel der Dysplasien (alle CIN) liegt mit etwa 22 von 100 betroffenen Frauen bei 27 Jahren. Die mittlere Gesamtprävalenz für CIN 2 und 3 wird auf 2,6% geschätzt.22
Dieser Modellrechnung liegt eine geschätzte Gesamtprävalenz für das Zervixkarzinom von etwa 45 pro 100.000 Frauen zugrunde. Mit einem Altersgipfel bei etwa 50 Jahren würde dies maximal eine pro 1.000 Frauen betreffen. Dieser Wert würde in der Grafik auf der Ordinate einem Skalenwert von 0,001 entsprechen. Das ist im Vergleich zu den CIN-Häufigkeiten so wenig, dass man die Kurve für das Zervixkarzinom über alle Altersgruppen optisch nicht von der Nulllinie unterscheiden könnte.
Demnach würden selbst schwere Dysplasien an der Zervix immer noch 20- bis 50-fach häufiger vorkommen als Zervixkarzinome. Das bedeutet, dass auch die meisten schweren Dysplasien harmlos sind, weil sie nicht zu einem invasiv wachsenden Krebs führen (vgl. auch Tabelle 3).
Wie häufig Dysplasien unter den aktuellen Screeningbedingungen in Deutschland sind, ist nicht bekannt. Hierzu gibt es nur wenige Untersuchungen, die letztlich jedoch keine verlässlichen Aussagen zulassen.33-36
Entwicklung der Zellveränderungen bei Nichtbehandlung (Tabelle 3): Nach SCHIFFMAN sollten nur CIN 3 und Carcinoma in situ als Präkanzerosen klassifiziert werden.23 Hingegen wären CIN 1 und CIN 2 keine sicheren Krebsvorstufen. Nach Schätzungen23 würde sich aus großen Präkanzerosen nach fünf bis zehn Jahren in 20% bis 30% ein invasives Karzinom entwickeln. Die Progressionsrate ist bei jungen Frauen sehr viel niedriger als bei älteren.27 Für Frauen zwischen 18 und 34 Jahren liegt die geschätzte Regressionsrate für alle CIN bei etwa 85%, bei älteren Frauen je nach Schwere zwischen 19% und 60%.37
Wie gut ist der Screeningtest?
Nach den international akzeptierten Kriterien für Screeningprogramme sollte ein Screeningtest einfach, sicher und präzise durchzuführen sein und zuverlässige Ergebnisse liefern. Die Verteilung der Testergebnisse in der Zielpopulation sollte bekannt sein, und es sollten geeignete Grenzwerte zur Differenzierung zwischen normal und pathologisch definiert und allgemein akzeptiert sein. Der Test sollte für die Zielpopulation annehmbar sein, und im Falle eines positiven Testergebnisses sollten den Betroffenen allgemein akzeptierte Vorgehensweisen zur weiteren Diagnostik angeboten werden können.14
DER PAP-TEST: Als Screeningmaßnahme erfolgt ein Zellabstrich mittels Bürste und Spatel von Portiooberfläche und Zervixkanal (PAPANICOLAOU-Abstrich, PAP-Test), in welchem entzündliche Veränderungen der Zellen, mögliche Präkanzerosen oder aber Tumorzellen nachgewiesen werden können. In Deutschland wird eine jährliche Untersuchung mit dem PAP-Test für alle Frauen ab einem Alter von 20 Jahren ohne Altersbegrenzung nach oben propagiert. Die Zielgruppe umfasst somit etwa 34 Mio. Frauen. Etwa 16,5 Mio. PAP-Abstriche werden pro Jahr in Deutschland über die Krankenkassen abgerechnet.21 Das sind etwa 2.500 PAP-Tests pro Zervixkarzinom.36
Die Befundung erfolgt nach der Münchener Nomenklatur II. Hierzu werden die zytologischen Befunde in fünf Klassen eingeteilt (Tabelle 4). Ab einem PAP-III-D besteht Verdacht auf eine Präkanzerose, ein In-situ Karzinom oder ein invasives Karzinom, und es werden weitere Abklärungsuntersuchungen notwendig.
Testeigenschaften: Der PAP-Test als Screeningmethode hat drei wesentliche Schwächen:
Eine schlechte Sensitivität. Dies hat zur Folge, dass nicht alle kanzerösen Veränderungen erkannt werden.
Eine schlechte Differenzierung zwischen harmlosen entzündlichen Veränderungen einerseits und Krebsvorstufen andererseits. Dies hat zur Folge, dass es viele auffällige Befunde gibt, die weiter abgeklärt werden sollen.
Eine schlechte Reproduzierbarkeit mit mangelnder Übereinstimmung in den Befunden zwischen Untersuchern.41
Idealerweise sollte ein Screeningtest auf Zervixkarzinom jene Frauen identifizieren, die tatsächlich ein invasives Karzinom entwickeln würden. Das wären nach Modellrechnungen, unter der Annahme, dass es kein Screening gäbe, für die Gesamtheit der Frauen zu einem bestimmten Zeitpunkt etwa 45 pro 100.000 Frauen.21,22 Der PAP-Test ist nicht dazu geeignet, diese Frauen eindeutig zu identifizieren. Auch mit anderen Testverfahren ist dies heute nicht möglich. Daher soll durch frühe Identifizierung und Entfernung aller vermeintlichen Krebsvorstufen verhindert werden, dass sich invasive Karzinome entwickeln
Tabelle 3: Geschätzte Häufigkeiten zur Regression, Persistenz und Progression von Dysplasien ohne Behandlung21,27,38

Tabelle 4: Klassifikation der PAP-Test-Befunde und Zuordnung zum vermuteten histologischen Befund sowie Empfehlungen für das weitere Vorgehen (nach21)

Der PAP-Test ist Teil eines mehrstufigen Diagnoseverfahrens. Mit dem Test soll die Gruppe der Frauen eingegrenzt werden, die ein höheres Risiko für Krebsvorstufen hat als die Gesamtgruppe der Frauen. Aus den im PAP-Test positiv getesteten Frauen soll durch weitere Tests, wie Kolposkopie, Biopsie und histologische Untersuchung, die Gruppe der Frauen weiter auf jene eingegrenzt werden, die mit noch größerer Wahrscheinlichkeit Zellveränderungen mit einem Potenzial zur Krebsentwicklung aufweisen.
Zu keinem Zeitpunkt kann das Testverfahren mit ausreichender Eindeutigkeit jene Frauen identifizieren, die tatsächlich ein invasives Karzinom entwickeln würden. Stattdessen soll durch das mehrstufige Testverfahren die Gruppe der Frauen immer weiter auf jene eingegrenzt werden, die ein sehr hohes Risiko haben. Die Fähigkeit eines Testverfahrens, dies zu leisten, zeigt sich in einer hohen Spezifität. Das ist die Fähigkeit, Gesunde bzw. nicht Gefährdete als solche zu identifizieren.
Je höher die Spezifität, umso schlechter wird jedoch die Sensitivität eines Testes. Das ist die Fähigkeit Kranke bzw. Gefährdete als solche zu identifizieren. Die Testeigenschaften können entweder für jeden Test einzeln oder für das gesamte Testverfahren analysiert werden.
Sensitivität und Spezifität: Da der PAP-Test primär nach möglichen Krebsvorstufen sucht, werden in der Literatur auch nur Angaben zur Sensitivität und Spezifität im Hinblick auf Präkanzerosen gemacht. Die Sensitivität des PAP-Tests für CIN 1 bis 3+ liegt international bei durchschnittlich 50% und für CIN 2/3 bei 50% bis 70%, bei einer Spezifität von durchschnittlich 95%.22,42
Das bedeutet, dass mit dem PAP-Test 30 bis 50 von 100 höhergradigen Zellveränderungen nicht erkannt werden und durchschnittlich 5 von 100 nicht gefährdeten Frauen auffällige Befunde haben.
Bei jüngeren Frauen ist die Sensitivität des PAP-Tests deutlich schlechter als bei älteren Frauen.43 Tabelle 5 zeigt ein Beispiel für die Güte des PAP-Tests zur Identifikation von Frauen mit CIN 3+.
Bezogen auf die Gruppe von Frauen, die tatsächlich ein Zervixkarzinom entwickeln würde, ist das Screening-Testverfahren noch schlechter. Dies liegt daran, dass das Zervixkarzinom sehr selten ist. Screening auf seltene Ereignisse ist stets unergiebig, wie ein Beispiel in der Tabelle 6 veranschaulicht. In diesem Beispiel werden rein hypothetisch, mit einer Sensitivität und Spezifität von jeweils 95%, ideale Testeigenschaften angenommen.
Das Beispiel veranschaulicht, dass es selbst bei unwahrscheinlich guten Testeigenschaften von Screeningverfahren nicht möglich ist, jene Frauen ausreichend verlässlich zu identifizieren, die tatsächlich ein Zervixkarzinom entwickeln würden. Viele Frauen werden ungerechtfertigt als gefährdet eingestuft und müssen sich weiteren Untersuchungen und Behandlungen unterziehen, obwohl sie niemals ein Zervixkarzinom entwickeln würden.
Tabelle 5: Güte des PAP-Tests zur Identifikation von Frauen mit CIN 3+ unter optimalen Testvoraussetzungen (Angaben bezogen auf 100.000 Frauen, davon 1.000 mit CIN 3+)
Die Zahlenangaben basieren auf folgenden Annahmen:
Der PAP-Test hat in diesem Beispiel eine Sensitivität von 70% und Spezifität von 95% zur Identifizierung von Frauen, die eine CIN 3+ Läsion haben.
Die erwartete Häufigkeit einer CIN 3+ Läsion in der untersuchten Population Frauen ist in diesem Beispiel 1.000 von 100.000 (1%), was an der oberen Grenze des zu erwartenden Risikos liegt. Dies wird auch als Vortestwahrscheinlichkeit oder Prävalenz bezeichnet. Wer gefährdet ist, ist nicht bekannt.

Erklärungen:
Häufigkeit positiver Befunde: Insgesamt 5.650 (6%) von 100.000 Frauen, die gescreent werden, haben einen positiven Befund (PAP-III-D+), der weiter kontrolliert bzw. abgeklärt werden muss.
Positiver prädiktiver Wert: Von den 5.650 Frauen mit positivem Befund sind jedoch nur 700 (12%) tatsächlich gefährdet. 88% haben bessere Befunde als CIN 3+. Wer die 12% gefährdeten Frauen sind, ist unbekannt. Um diese zu identifizieren, müssen weitere Untersuchungen wie Kolposkopie mit Biopsie und Histologie durchgeführt werden.
Negativer prädiktiver Wert: Schon vor dem Screening sind 99.000 von 100.000 Frauen nicht gefährdet (negative Vortestwahrscheinlichkeit 99%). Von den Frauen, die ein negatives Testergebnis haben (94.350), sind tatsächlich 94.050 nicht gefährdet. Ein negatives Testergebnis erhöht die Wahrscheinlichkeit für Nichtgefährdung somit auf 99,7%.
In Deutschland versucht man, die schlechte Sensitivität des PAP-Tests für Präkanzerosen durch kurze Screeningintervalle von nur einem Jahr auszugleichen. Dadurch nimmt einerseits die Wahrscheinlichkeit ab, dass sich in der untersuchten Population gefährdete Frauen befinden. Andererseits nimmt mit häufigem Testen die Rate an falsch positiven Befunden zu, die weiter kontrolliert bzw. abgeklärt werden müssen, ohne dass jedoch Krebsgefahr besteht.
Wenn, wie in Deutschland empfohlen, ab dem 20. Lebensjahr über die gesamte weitere Lebenszeit jährlich ein PAP-Test durchgeführt werden soll, dann nimmt die Wahrscheinlichkeit zu, dass die Frauen identifiziert werden, die tatsächlich ein Karzinom bekommen würden. Die Sensitivität nimmt zu. Je höher die Sensitivität, umso wahrscheinlicher ist es aber auch, einen falsch positiven Befund zu erhalten. Nach Schätzungen erhalten unter diesen Bedingungen mindestens 50% der Frauen im Laufe ihres Lebens mindestens einmal einen abklärungsbedürftigen Screeningbefund.8,44
Tabelle 6: Hypothetisches Beispiel für ein optimales Screening-Testverfahren (Angaben bezogen auf 100.000 Frauen, davon 100 gefährdet für ein invasives Zervixkarzinom)
Die Zahlenangaben basieren auf folgenden Annahmen:
Das Screening-Testverfahren hat in diesem Beispiel eine Sensitivität und Spezifität von jeweils 95% zur Identifizierung von Frauen, die tatsächlich ein Zervixkarzinom entwickeln würden.
Die Wahrscheinlichkeit, dass in der untersuchten Population Frauen sind, die ohne Screening ein Zervixkarzinom entwickeln würden, beträgt in diesem Beispiel 100 von 100.000 (0,1%), was an der oberen Grenze des erwartenden Risikos liegt (Vortestwahrscheinlichkeit oder Prävalenz). Wer gefährdet ist, ist nicht bekannt.
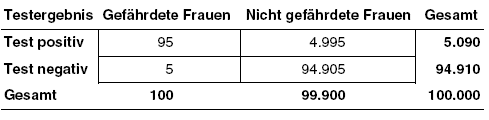
Erklärungen:
Häufigkeit positiver Befunde: Insgesamt 5.090 (5%) von 100.000 Frauen, die gescreent werden, haben einen positiven Befund, der weiter kontrolliert bzw. abgeklärt werden muss.
Positiver prädiktiver Wert: Von den 5.090 Frauen mit positivem Befund würden 95 (2%) ein Zervixkarzinom entwickeln. Wer das ist, ist unbekannt.
Negativer prädiktiver Wert: Schon vor dem Screening sind 99.900 (99,9%) von 100.000 Frauen nicht gefährdet. Von den 94.910 Frauen mit negativem Testergebnis sind tatsächlich 94.905 (99,99%) nicht gefährdet.
Es gibt große Unterschiede in den Testqualitäten zwischen Zentren. Die Sensitivität des PAP-Tests schwankt zwischen 11% und 99% bei einer Spezifität zwischen 14% und 97%.45,46 Die so genannte Interobserver-Reliabilität für den PAP-Test ist mit einem kappa von etwa k = 0,5***** nur mäßig gut.41,47 Nur in 12%47 bzw. 65%41 gab es Übereinstimmung in den Befunden durch ausgewiesene Experten. Selbst bei schwerwiegenden Präkanzerosen stimmten Befunder nur in 47 von 100 Fällen überein.41
| ***** | Cohens kappa ist ein statistisches Maß für die Übereinstimmung von Einschätzungen mehrerer Beurteiler. Ein Wert von 1 bedeutet vollständige Übereinstimmung, 0 bedeutet zufällige Übereinstimmung. Werte zwischen 0,4 und 0,6 gelten als moderate Übereinstimmung. |
Für Deutschland liegen wenige systematische Untersuchungen zu den PAP-Testqualitäten vor. Die Sensitivität liegt überwiegend unter 50%, mit deutlichen Schwankungen zwischen Zentren. Angaben variieren zwischen 12% und 21% für jüngere Frauen und 50% und 100% für ältere Frauen.33,34,43
Nach Schätzungen liegt die Rate an positiven Befunden beim PAP-Test bei einmaliger Anwendung im Bevölkerungs-screening zwischen 3% und 8%.48 Im Routinescreening bei einer jährlichen Teilnahmerate von etwa 50% der Frauen zwischen 20 und 84 Jahren liegen für Deutschland folgende Schätzungen vor:49
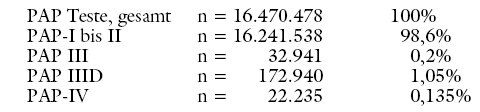
Bei einem diagnostischen Schwellenwert von PAP-IIw+ (siehe Tabelle 4) liegt im Routinescreening die Positivrate bei 3,1%.50 Im britischen Modell mit Screeningintervallen von 3 bis 5 Jahren erhalten 30% bis 40% der jüngeren Frauen im Laufe ihres Lebens mindestens einmal einen positiven Befund.51 Für jährliches Screening gibt es Schätzungen für das Lebenszeitrisiko eines falsch positiven Befunds bis über 80%.44
KOLPOSKOPIE: Die Kolposkopie wird zur Inspektion der Portio und zur Biopsie eingesetzt. Die Sensitivität zur Diagnose eines Zervixkarzinoms ist jedoch mit etwa 50% schlecht. Biopsieort und Befundung zeigen eine hohe Variabilität und schlechte Reproduzierbarkeit. Falsch negative Kolposkopien bei histologisch nachweisbaren Präkanzerosen finden sich selbst bei routinierten Befundern in 20% bis 40% der Fälle.23 Die Kolposkopie wird nicht als primäre Screeningmethode empfohlen.52
HISTOLOGIE: Goldstandard ist die histologische Diagnose an einer Gewebeprobe aus dem Portiobereich. Dabei ist auch die histologische Diagnose für Fehler anfällig, je nachdem, ob aus dem tatsächlich befallenen Bereich Gewebeproben entnommen werden oder nicht. Auch in optisch unauffälligen Bereichen kann sich ein Zervixkarzinom befinden. Bei etwa 10 von 1.000 Frauen mit negativem histologischem Befund wird später dennoch klinisch ein Zervixkarzinom diagnostiziert.23
Auch die Übereinstimmung histologischer Befunde aus Biopsien mit histologischen Befunden aus nachfolgend gewonnenen Gewebeproben durch Konisation bzw. nochmaliger Biopsie unmittelbar vor ablativer Behandlung ist nicht vollständig. In einer aktuellen Studie aus Kanada53 fand sich eine Übereinstimmung für höhergradige Zelldysplasien (CIN2+) lediglich in 40 (73%) von 55 solcher Gewebeproben. Das heißt, bei 15 (27%) der 55 Frauen, die eine eingreifende Behandlung aufgrund eines positiven Biopsiebefundes erhielten, fanden sich keine höhergradigen Zellveränderungen in dem nachfolgend entfernten Gewebe.
Auch für die histologische Befundung gibt es nur eine mäßige Übereinstimmung zwischen den Pathologen. In einer Arbeit41 betrug das kappa ***** etwa k = 0,50, sowohl für Gewebeproben, die durch Biopsie gewonnen wurden, als auch in jenen, die nach elektrischer Schlingenabtragung zur Untersuchung kamen. Selbst bei schweren Zellveränderungen stimmten die Pathologen nur in 77 von 100 Fällen überein, dass eine solche schwere Zellveränderung vorlag. In einer deutschen Studie unter Routinescreening wurden nur 46 (53%) von 86 der bei Kolposkopie gewonnenen pathologischen histologischen Befunde (CIN 2+) bei Zweitbegutachtung durch erfahrene Pathologen bestätigt.34 Nach Analysen aus Mecklenburg-Vorpommern zeigt die histologische Aufarbeitung von operativ gewonnenen Gewebeproben in 44% die Stadien CIN 1 bis CIN 2. Diese Eingriffe, meist durch Konisationen, wären zu vermeiden gewesen.35
| ***** | Cohens kappa ist ein statistisches Maß für die Übereinstimmung von Einschätzungen mehrerer Beurteiler. Ein Wert von 1 bedeutet vollständige Übereinstimmung, 0 bedeutet zufällige Übereinstimmung. Werte zwischen 0,4 und 0,6 gelten als moderate Übereinstimmung. |
HPV-DNA-TEST ALS SCREENINGTEST? Alle derzeit marktgängigen HPV-Tests weisen virale DNA im Plattenepithel der Zervix uteri nach. Zwei Testverfahren werden angewandt: Der HC-2-Test erkennt Gruppen ausgewählter Virusvarianten, die PCR-Methode dient der exakten Typisierung.50 Ein negativer HPV-Test schließt eine frühere Infektion nicht aus. Auch die Persistenz von kanzerogenen HP-Viren ist bei negativem Testergebnis nicht auszuschließen.23 Bei jungen Frauen ist der Test in etwa 50% positiv und daher als Screeningtest ungeeignet.23,26 Bei älteren Frauen (ab etwa 50 Jahren) zeigt ein negatives Testergebnis jedoch ein niedriges Risiko für Zervixkarzinom an.54
Die Frage, ob der HPV-Test bei Frauen über 30 als Screeningtest geeignet ist, wurde kürzlich in einer großen kanadischen Studie untersucht.53 Unter Studienbedingungen hatte der HPV-Test eine höhere Sensitivität, aber eine schlechtere Spezifität als der PAP-Test und führte, bei gleichzeitig höherer Positivrate, zu einem schlechteren positiven Vorhersagewert. Unter realen Bedingungen scheint der HPV-Test zudem seine Überlegenheit in Bezug auf Sensitivität zu verlieren.53
Auch der HPV-Test zeigt, vor allem bei unklaren Zellbefunden, eine Varianz zwischen Untersuchern. In einer Studie schwankte der Nachweis von HP-Viren zwischen Befundern, bei einer tatsächlichen Infektionshäufigkeit von etwa 50%, zwischen 38% und 67%.55 Nach verschiedenen Gutachten wird ein generelles Screening mit HPV-Test derzeit in Deutschland nicht empfohlen.50 Standardisierung des Verfahrens wäre eine Grundvoraussetzung für die Einführung.23 Weitere Studien sollen die offenen Fragen klären.56
Die Behandlung
Die Behandlung bei bedenklichem Befund besteht in der Destruktion oder Exzision der gesamten Transformationszone, nicht nur der spezifischen präkanzerösen Anteile. 80% bis 95% der behandelten Frauen bleiben rezidivfrei.23
DESTRUIERENDE VERFAHREN:
Laservaporisation (Koagulation des Gewebes mit energiereichem Laserlicht)
Kryotherapie (Gewebedestruktion durch Kontaktvereisung mit Kühlmitteln wie Flüssigstickstoff, Lachgas oder Kohlenmonoxid)
Elektrokauterisierung (Gewebedestruktion durch Hitzeanwendung)
Nachteilig ist, dass die Gewebezerstörung nachfolgende histologische Untersuchungen behindert. Ein Vorteil liegt in der geringeren Häufigkeit von Nebenwirkungen und der ambulanten Durchführbarkeit.
Auch die endozervikale Kürettage dient nicht nur zur Gewinnung von Gewebeproben, sondern darüber hinaus auch zur Behandlung von Dysplasien im Zervixkanal.
EXZISIONSVERFAHREN (KONISATION): Es gibt verschiedene Operationsmethoden:
Skalpell (Messer)
Laser (CO2-Laser)
Elektrische Schlinge
Der Eingriff kann in Voll- oder Teilnarkose (Leitungsanästhesie), ambulant oder stationär erfolgen. Er wird üblicherweise als harmlos, also nebenwirkungsarm dargestellt. Dies entspricht jedoch nicht der Datenlage. So haben Frauen mit einer Reihe möglicher Komplikationen im Zusammenhang mit der Operation zu rechnen, deren Häufigkeit auf 2% bis 7% geschätzt wird:37
Blutungen, eventuell mit der Notwendigkeit einer neuerlichen Operation oder Bluttransfusion
Verschluss des Gebärmutterhalses mit Ansammlung von Flüssigkeit im Uterus (langfristig Infertilität möglich)
Verletzungen der Blase oder des Mastdarms
Entzündungen, Antibiotikagabe (Folgekomplikationen wie Fertilitätsstörungen?)
Autoren aus Deutschland berichten, bei allerdings relativ kleinen Gruppen von Frauen, bessere Ergebnisse für Konisation mit der Schlinge als mit dem Messer,40 bei insgesamt aber eher hohen Komplikationsraten. Die perioperative Komplikationsrate betrug 6% (Schlinge) versus 11% (Messer) bei vergleichbarer Resektion nicht im Gesunden (20% versus 19%) und vergleichbarer Rezidivrate (4% versus 3%).
Inzwischen haben mehrere Studien über eine erhöhte Rate an Schwangerschaftskomplikationen bei Frauen berichtet, die vor der Schwangerschaft eine Konisation hatten.57-59 Tabelle 7 zeigt exemplarisch Ergebnisse aus einer Arbeit.57
Bei einer Behandlung von CIN 3 oder Carcinoma in situ (CIS) durch Konisation ist nach einer schwedischen Auswertung bei etwa fünf bis zehn von 1.000 Frauen mit einem Rezidiv zu rechnen. Das Risiko ist in den ersten zwei Jahren nach dem Eingriff am höchsten.60 In England liegt die Rezidivrate bei etwa sechs von 1.000 behandelten Frauen.51
EMPFEHLUNGEN IN DEUTSCHLAND: Die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e.V. und die Deutsche Krebsgesellschaft empfehlen in ihrer S2-Leitlinie39
bei Persistenz (Kontrolle im Abstand von 3 Monaten) einer CIN-1-Läsion an der Ektozervix die Durchführung einer Biopsie, eventuell CO2-Laservaporisation, bei endozervikalem Sitz eine großzügige Indikation zur Konisation
für CIN-2-Läsionen bei Persistenz über ein Jahr und bei CIN 3 unmittelbare Behandlung mit Konisation.
Da CIN-2- und CIN-3-Läsionen gerade bei Frauen im Alter zwischen 25 und 35 Jahren häufig auftreten (vgl. Abbildung 1, Seite 31), sind diese Eingriffe nicht unbedeutend in Bezug auf zukünftige Schwangerschaften. Ein erhebliches Problem besteht auch darin, dass die Konisation häufig noch in einem Schritt zur Diagnose und gleichzeitigen Behandlung durchgeführt wird.40
HÄUFIGKEIT VON KONISATIONEN: Nach Daten der Techniker Krankenkasse erfolgten im Jahr 2006 bei den insgesamt 2.900.000 versicherten Frauen etwa 9.700 Konisationen, davon etwa 8.100 ambulant und 1.600 stationär.61 Auf die weibliche Gesamtpopulation in Deutschland von etwa 42 Mio. hochgerechnet wären das 140.000 Konisationen pro Jahr oder etwa 330 pro 100.000 Frauen (0,3%) pro Jahr.
HYSTEREKTOMIEN: Nach Auswertungen der so genannten Diagnosis Related Groups (DRG) wurden im Jahr 2006 etwa 100.000 "benigne" Hysterektomien durchgeführt, davon etwa 2.200 mit der Indikation "in-situ Zervixkarzinom einschließlich CIN 3".62 Auf die Gesamtheit der 42 Mio. Frauen in Deutschland bezogen sind das 244 "benigne" Hysterektomien pro 100.000 Frauen (0,24%) pro Jahr, davon 6 pro 100.000 Frauen pro Jahr wegen Zervix-Präkanzerosen.61,62 Neben den akuten Komplikationen wie Organverletzungen, die bei "benigner" Hysterektomie auf 1% geschätzt werden,63 ist langfristig nach Hysterektomie auch das Risiko einer Harninkontinenz erhöht. Das Risiko eines chirurgischen Eingriffs wegen Stressinkontinenz steigt auf das 2,4fache.64

Tabelle 8: Geschätztes jährliches Risiko für Zervixkarzinom und operative Eingriffe zur Abklärung und Behandlung von Krebsvorstufen pro 100.000 Frauen nach Altersgruppen

Das Programm zum Screening auf Zervixkarzinom
Screeningprogramme sollten nur eingeführt werden, wenn qualitativ hochwertige, randomisierte kontrollierte Studien eine Senkung der Mortalität belegt haben.14 Zum Screening auf Zervixkarzinom gibt es solche Untersuchungen nicht. Aus diesen Gründen sind Angaben zum Nutzen des Screenings spekulativ. Nach den internationalen Vorgaben sollten Screeningprogramme zudem nur unter Qualitätssicherung eingeführt werden.14
FEHLENDE QUALITÄTSSICHERUNG IN DEUTSCHLAND: Hierzulande wird das Screening opportunistisch, ohne Qualitätssicherung durchgeführt. Für eine Teilkomponente des Screenings, die zytologische Diagnostik, gibt es seit Ende 2007 eine Richtlinie zur Qualitätssicherung.65 Nicht spezifische Qualitätssicherung betrifft z.B. im Rahmen der BQS****** die Hysterektomien.63
| ****** | BQS = Bundesgeschäftsstelle Qualitätssicherung |
Tabelle 9 zeigt die diagnostischen und therapeutischen Maßnahmen, die bei auffälligen PAP-Befunden in Deutschland in gynäkologischen Praxen durchgeführt werden.

Auf 600 Frauen kamen insgesamt 270 verschiedene Vorgehensweisen. Bei 40% der Frauen erfolgte ein therapeutischer Eingriff ohne vorherige histologische Abklärung. Der Grad der Übereinstimmung zwischen zytologischem Eingangsbefund (PAP-Test) und schwerstgradigem histologischen Befund (CIN) war nur mäßig gut, mit einem kappa von etwa k=0,5. Insgesamt erwiesen sich 61% der unklaren zytologischen Befunde im Nachhinein als histologisch negativ. Von den Frauen mit PAP-III-D hatten 30% und von denen mit PAP-IV-A 4% histologisch negative Befunde. Bei etwa jeder fünften Frau lag ein abnormaler PAP-Befund vor, der histologisch nicht zu verifizieren war. Andererseits fand sich auch bei etwa jeder 5. Frau bei nur geringen zytologischen Veränderungen ein höhergradiger histologischer Befund.66
MÖGLICHER NUTZEN: Die Abnahme der Häufigkeit des Zervixkarzinoms seit den 1970er Jahren wird üblicherweise auf die Einführung des Screenings zurückgeführt.44 Es gibt dazu jedoch viele offene Fragen, die Analysen basieren auf zahlreichen, schlecht gestützten Annahmen. Der Zusammenhang ist letztlich nicht zu quantifizieren.
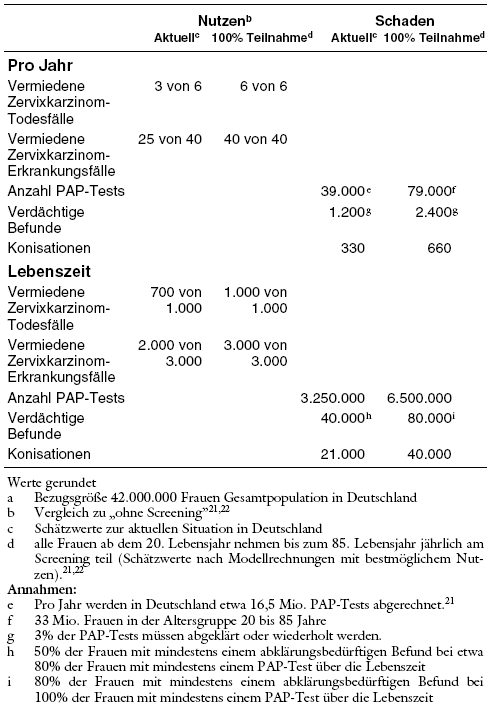
Unter den aktuellen Bedingungen in Deutschland werden nach Schätzungen durch das Screening etwa drei Todesfälle und 25 Erkrankungsfälle pro 100.000 Frauen pro Jahr verhindert. Optimistische Modellrechnungen stellen eine Prävention der Erkrankungsrate durch Screening auf Zervixkarzinom um bis zu 99% und der Todesfälle um fast 100% in Aussicht (Tabelle 10).22 Aufgrund der umfangreichen Datenanalysen des qualitätsgesicherten britischen Programms mit Screeningintervallen von 3 bis 5 Jahren bei hohen Teilnahmeraten wird jedoch eine Abnahme der Krankheits- und Sterbefälle um höchstens 50% als realistisch angesehen. In England haben mehr als 60% aller vor dem 45. Lebensjahr am Zervixkarzinom verstorbenen Frauen regelmäßig am Screening teilgenommen.51 Auch in Deutschland haben bis zu 50% der Frauen, bei denen ein Zervixkarzinom diagnostiziert wird, am Screening teilgenommen, zum Teil auch mit normalen PAP-Befunden.33,35,40 Im Vergleich zu anderen europäischen Ländern liegen Morbidität und Mortalität des Zervixkarzinoms in Deutschland im Mittelfeld.37 Sieht man allerdings von den ehemaligen Ostblockstaaten ab, sind die Ergebnisse nur in Dänemark schlechter als in Deutschland.
Wegen des jährlichen Screenings werden in Deutschland ungleich mehr Untersuchungen durchgeführt als in anderen Ländern, in denen die Screeningintervalle drei bis fünf Jahre betragen. Deutsche HTA-Berichte zeigen, dass die Verlängerung der Screeningintervalle von einem auf drei bis fünf Jahre nur zu einer vernachlässigbaren Abnahme des möglichen Nutzens führen würde.21,22,67******* Obwohl dies nicht analysiert wurde, wäre jedoch gleichzeitig mit einer drastischen Abnahme von falsch positiven Befunden und operativen Eingriffen zu rechnen. Trotzdem wird in Deutschland weiterhin das jährliche Screening propagiert.
| ******* | Unter der optimistischen Annahme, dass durch Screening im 1-Jahres-Intervall vom 20. Lebensjahr bis zum Tod (65 Screeninguntersuchungen) fast 100% der Zervixkarzinomtodesfälle (1.000 von erwarteten 1.004 ohne Screening pro 100.000 Frauen) verhindert werden könnten, wären es für ein 3-Jahres-Screeningintervall (22 Screeninguntersuchungen) 95% (951) und bei einem 5-Jahres-Intervall (13 Screeninguntersuchungen) 87% (876). In gewonnener Lebenszeit wäre dies eine Abnahme von 94 Tagen (mittlere Lebensverlängerung bei 1-Jahres-Screeningintervall im Vergleich zu keinem Screening) auf 88 (3-Jahres-Intervall) bzw. 80 Tage (5-Jahres-Intervall). |
SCHADEN - HUMANE KOSTEN: Dem begrenzten Nutzen des Screenings stehen negative Effekte wie insbesondere Überdiagnosen und Übertherapie mit entsprechenden Folgen für die Frauen gegenüber.
Überdiagnosen und Übertherapien: Unter den aktuellen Bedingungen in Deutschland werden pro Jahr und pro 100.000 Frauen (Gesamtbevölkerung) etwa 39.000 PAP-Tests durchgeführt, etwa 1.200 Frauen erhalten unklare oder verdächtige Befunde, die weiter abgeklärt werden müssen,22,68,69 etwa 330 Frauen erhalten eine Konisation und sechs eine Hysterektomie zur Behandlung von zervikalen Dysplasien.62,69 Auf die Lebenszeit bezogen wären es geschätzt 3.250.000 PAP-Tests, 40.000 abklärungsbedürftige Befunde und etwa 21.000 Konisationen pro 100.000 Frauen (Tabelle 10). Die Mehrzahl dieser abklärungsbedürftigen verdächtigen Befunde und der Behandlungen betrifft Frauen, die auch ohne Screening zeitlebens kein Zervixkarzinom entwickeln würden.
Tabelle 10: Möglicher Nutzen und Schaden des Screenings auf Zervixkarzinom nach Screeningintensität (Anzahl pro 100.000 Frauena)
Psychologische Folgen und Lebensqualität: In einer aktuellen Studie aus Schweden hatten 30% der Frauen, die wegen eines auffälligen PAP-Testbefunds zur Kolposkopie überwiesen worden waren, nach zwei Jahren immer noch Angst, Krebs zu haben.70 Daten zur Lebensqualität fehlen. Lediglich Angaben von Experten - nicht von betroffenen Frauen - liegen vor.21,71 Auswirkungen auf Psyche, Sexualleben etc. sind kaum untersucht.
Falsche Beruhigung: Es ist sicher, dass nicht alle Karzinome rechtzeitig erkannt werden können, auch wenn die Screeningtermine eingehalten werden. Der Anteil der Frauen, bei denen ein Zervixkarzinom diagnostiziert wurde, die jedoch Screeninguntersuchungen bzw. normale PAP-Befunde hatten, reicht bis zu 50%.33
Kosten: Die Angaben zu den Kosten für das Screening variieren, je nachdem ob nur die Kosten genannt werden, die direkt mit der Durchführung des PAP-Tests entstehen, oder ob auch die Folgekosten berechnet werden, die durch diagnostische und therapeutische Eingriffe aufgrund der weiter abklärungsbedürftigen oder positiven PAP-Befunde entstehen. Die Gesamtkosten für Deutschland pro Jahr werden zwischen 335 Mio. Euro66 und 700 Mio. Euro49 geschätzt.
HPV-Impfung plus Screening?
KONTROLLIERTE STUDIEN ANGEMAHNT: Zur Implementierung der HPV-Impfung (GARDASIL, CERVARIX) hat das Europäische Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC) eine Anleitung publiziert. Demnach ist jedes Land aufgerufen zu prüfen, ob überhaupt bzw. unter welchen Bedingungen eine HPV-Impfung eingeführt werden soll. Das ECDC geht davon aus, dass die HPV-Impfung nicht für jedes Land ein ausreichendes Nutzen-Kosten-Verhältnis hat, wonach eine Implementierung zu rechtfertigen wäre. In jedem Fall wird, soweit noch nicht vorhanden, die Etablierung eines Qualitätssicherungssystems sowohl für die Impfung als auch für das Screening auf Zervixkarzinom angemahnt.27
Es wird auf die vielen offenen Fragen und Unsicherheiten zur HPV-Impfung verwiesen, die nur unter kontrollierten Bedingungen beantwortet werden könnten. Dies ist besonders relevant für Deutschland, da es hier weder eine Qualitätssicherung des Screenings noch Ansätze zur Überprüfung der Auswirkungen der HPV-Impfung auf Bevölkerungsebene gibt.
Das ECDC fordert als minimalen Standard eine Dokumentation des Anteils der Personen, die geimpft werden, ein Monitoring der Nebenwirkungen der Impfung und mindestens eine Überwachung der Auswirkungen auf die Präkanzerosen.27
Ausdrücklich wird darauf verwiesen, dass randomisierte kontrollierte Phase-IV-Studien das beste Potenzial hätten, verlässliche Daten zu generieren.27 Eine eventuelle Integration neuer Screeningmethoden wie die HPV-DNA-Testung oder möglicherweise auch HPV-Typisierung sollten im Rahmen von randomisierten kontrollierten Studien untersucht werden.
NUTZEN ÜBERSCHÄTZT: Ein aktueller HTA-Bericht hat die ökonomischen Auswirkungen einer Implementierung der HPV-Impfung in Österreich analysiert.71 Da sowohl in Österreich als auch in Deutschland das Zervixkarzinom-Screening nicht qualitätsgesichert, sondern opportunistisch abläuft, und die Erkrankungs- und Mortalitätsraten ähnlich sind, ist dieser HTA-Bericht zumindest als Orientierung auch hierzulande von Interesse, zumal für Deutschland ein solcher Bericht noch nicht vorliegt. Der Bericht kommt zu folgenden wesentlichen Schlussfolgerungen:
Bei Einführung der HPV-Impfung unter den aktuellen Screeningbedingungen wird bis zum Jahr 2060 die Zervixkarzinom-Erkrankungsrate im Mittel um 9% sinken, bei optimalen Bedingungen um maximal 10%. Das wären bis 2060 jährlich durchschnittlich vier Neuerkrankungen pro 100.000 Frauen weniger. Die Todesfälle werden um durchschnittlich 11% bis 13% abnehmen (ein Todesfall pro 100.000 Frauen pro Jahr weniger). Die Zusatzkosten sind erheblich (5% bis 10% des gesamten Präventionsbudgets).
Bei Impfung von Mädchen und Jungen ist mit einer Abnahme der Erkrankungsrate um 14% bis 15% und der Mortalitätsrate um 18% bis 20% zu rechnen, bei ungleich höheren zusätzlichen Kosten.
Somit liegt die Prognose im besten Fall deutlich unter der vielfach erwarteten 70%igen Reduktion von Zervixkarzinomen, unter der Annahme, dass die Impfung die HPV-Typen 16 und 18 eliminiert, die in 70% aller Zervixkarzinome beobachtet wurden. Gründe sind die Problematik der Virusdynamik und Zeithorizonte.71 Die Auswirkungen der Impfung auf die Screeningsensitivität sind unklar. In jedem Fall führt die Impfung dazu, dass der positive Vorhersagewert des Screenings sinkt und der negative Vorhersagewert steigen wird. Dieser ist aber in jedem Fall schon von vornherein fast 100%.
Schlussfolgerungen
Das Nutzen-Schaden-Verhältnis des Screenings auf Zervixkarzinom kann für Deutschland nur mit großer Unsicherheit abgeschätzt werden.
Bisher gibt es keine Qualitätssicherung des Screeningprogramms in Deutschland.
Unter den aktuellen Bedingungen in Deutschland werden durch das Screening pro Jahr und pro 100.000 Frauen (Gesamtbevölkerung) etwa 3 Todesfälle und 25 Erkrankungsfälle an Zervixkarzinom verhindert. Dem stehen etwa 39.000 PAP-Tests, 1.200 abklärungsbedürftige Befunde und 330 Konisationen zur Behandlung von zervikalen Dysplasien gegenüber. Auf die Lebenszeit bezogen wären es geschätzt pro 100.000 Frauen 700 verhinderte Todesfälle und 2.000 verhinderte Erkrankungsfälle, dem stehen 3.250.000 PAP-Tests, 40.000 abklärungsbedürftige Befunde und etwa 21.000 Konisationen gegenüber.
Die HPV-Impfung stellt prinzipiell eine mögliche Primärprävention für einen Teil der Zervixkarzinome dar.
Der mögliche Nutzen einer HPV-Impfung unter den derzeitigen Bedingungen des Screenings wird jedoch erheblich überschätzt (a-t 2008; 39: 17-8). Unerwünschte Folgen sind nicht abzuschätzen. Die zusätzlichen Kosten sind beträchtlich.
Die Implementierung der HPV-Impfung in Deutschland ohne Standardisierung und systematische Kontrolle der Auswirkungen der Impfung und ohne Systematisierung und Dokumentation der Ergebnisse des Screenings auf Zervixkarzinom durch aussagekräftige Begleitstudien stellt ein unkontrolliertes Experiment mit der weiblichen Bevölkerung dar.
Empfehlungen
Kontrollierte Studien zu den Auswirkungen des Zervixkarzinomscreenings und der HPV-Impfung in Deutschland müssen umgehend initiiert werden.
Kinder und Jugendliche sollten nur im Rahmen kontrollierter Dokumentation eine HPV-Impfung und im späteren Alter eine Screeninguntersuchung auf Zervixkarzinom erhalten.
Die Verlängerung der Screeningintervalle auf drei bis fünf oder mehr Jahre sollte Standard werden.
Das Nutzen-Schaden-Verhältnis eines generellen Screenings ab dem 20. Lebensjahr im Vergleich zu späterem Screeningbeginn sollte überprüft werden.
Evidenzbasierte Leitlinien für das Screening müssen erstellt und umgesetzt werden.
Konisationen oder andere operative Eingriffe an der Gebärmutter ohne histologische Abklärung dürfen nicht mehr durchgeführt werden.
Die Frauen müssen in alle Entscheidungsprozesse im Sinne einer informierten bzw. partizipativen Entscheidungsfindung einbezogen werden.
Hierzu müssen evidenzbasierte unabhängige und verständliche Informationen in schriftlicher Form den Frauen verfügbar gemacht werden.
| 1 | Gemeinsamer Bundesausschuss: Richtlinie zur Umsetzung der Regelungen in § 62 für schwerwiegend chronisch Erkrankte ("Chroniker-Richtlinie"), letzte Änderung 19. Juli 2007; Bundesanzeiger 2007; Nr. 198: S. 7821; http://www.g-ba.de/downloads/62-492-140/RL_Chroniker_2007-07-19.pdf; Zugriff am 10. März 2008 | |
| 2 | SIROVICH, B.E., WELCH, H.G.: JAMA 2004; 291: 2990-3 | |
| 3 | SCHWARTZ, L.M. et al.: JAMA 2004; 291: 71-8 | |
| 4 | JØRGENSEN, K.J., GØTZSCHE, P.C.: BMJ 2004; 328: 148 (6 Seiten) | |
| 5 | General Medical Council: Seeking patients' consent: the ethical considerations. Nov. 1998; http://www.gmc-uk.org/guidance/current/library/consent.asp; Zugriff am 10. März 2008 | |
| 6 | Health & Consumer Protection. Directorate-General: European guidelines for quality assurance in breast cancer screening and diagnosis. Fourth Edition, European Communities, 2006
zu finden unter http://www.ec.europa.eu; Zugriff am 10. März 2008 | |
| 7 | STECKELBERG, A. et al.: Z. ärztl. Fortbild. Qual. Gesundh.wes. 2005; 99: 343-51 | |
| 8 | WELCH, H.G.: Should I Be Tested for Cancer? Maybe Not and Here's Why; Berkeley, Los Angeles, London: University of California Press 2004 | |
| 9 | MÜHLHAUSER, I.: Z. ärztl. Fortbild. Qual. Gesundh.wes. 2007; 101: 293-9 | |
| 10 | MÜHLHAUSER, I, HÖLDKE, B.: arznei-telegramm 1999; Nr. 10: 101-8 | |
| 11 | Nationales Netzwerk Frauen und Gesundheit (Hrsg.) Brustkrebs. Früherkennung. Informationen zur Mammografie - eine Entscheidungshilfe. 2007; zu finden unter http://www.nationales-netzwerk-frauengesundheit.de | |
| 12 | STECKELBERG, A., MÜHLHAUSER, I. (Hrsg.): Darmkrebs Screening, Hamburg 2003; zu finden unter http://www.gesundheit.uni-hamburg.de | |
| 13 | WILSON, J.M.G., JUNGNER, G.: Principles and practice of screening for disease. Public Health Paper Number 34. Geneva: WHO, 1968 | |
| 14 | UK National Screening Committee: Criteria for appraising the viability, effectiveness and appropriateness of a screening programme http://www.nsc.nhs.uk/pdfs/criteria.pdf; Zugriff am 10. März 2008 | |
| 15 | Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG): Allgemeine Methoden, Entwurf für Version 3.0 vom 15. Nov. 2007; zu finden unter: http://www.iqwig.de; Zugriff am 10. März 2008 | |
| 16 | Robert Koch-Institut/Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (GEKID) (Hrsg.): Krebs in Deutschland 2003-2004 - Häufigkeiten und Trends, 6. Aufl. 2008; zu finden unter http://www.rki.de (r) Gesundheitsberichterstattung (r) Dachdokumentation Krebs (r) Broschüre zu Krebs; Zugriff am 10. März 2008 | |
| 17 | Statistisches Bundesamt. DESTATIS. Todesursachen in Deutschland. Fachserie 12 Reihe 4 - 2006 | |
| 18 | WALTER, L.C., COVINSKY, K.E.: JAMA 2001; 285: 2750-6 | |
| 19 | Tumorregister München: Datenbankstand 13. Okt. 2007 http://www.tumorregister-muenchen.de; Zugriff am 10. März 2008 | |
| 20 | Robert Koch-Institut (Hrsg.)/Statistisches Bundesamt: Gesundheitsberichterstattung des Bundes - Heft 37 - Gebärmuttererkrankungen; Berlin, Jan. 2007
zu finden unter: http://www.rki.de (r) Gesundheitsberichterstattung (r) Themenhefte (r) Gebärmuttererkrankungen; Zugriff am 10. März 2008 | |
| 21 | SIEBERT, U. et al.: Dünnschichtpräparationen und computergestützte Untersuchungen von Zervixabstrichen. Asgard-Verlag, St. Augustin, 2003 http://gripsdb.dimdi.de/de/hta/hta_berichte/hta067_bericht_de.pdf; Zugriff am 10. März 2008 | |
| 22 | SIEBERT, U. et al.: Eur. J. Publ. Health 2006; 16: 185-92 | |
| 23 | SCHIFFMAN, M. et al.: Lancet 2007; 370: 890-907 | |
| 24 | PETTIFER, C.: Cervical cancer and HPV infections in the European Union. In: European Centre for Disease Prevention and Control. Guidance for the introduction of HPV vaccines in EU countries. Stockholm, Jan. 2008; http://www.ecdc.europa.eu/pdf/HPV_report.pdf; Zugriff am 10. März 2008 | |
| 25 | PETRY, K.U.: Hautarzt 2007; 58: 501-6 | |
| 26 | DUNNE, E.F. et al.: JAMA 2007; 297: 813-9 | |
| 27 | European Centre for Disease Prevention and Control: Guidance for the introduction of HPV vaccines in EU countries. Stockholm, Jan. 2008 http://www.ecdc.europa.eu/pdf/HPV_report.pdf; Zugriff am 10. März 2008 | |
| 28 | SCHIFFMAN, M., KJAER, S.K.: J. Natl. Cancer Inst. Monogr. 2003; Nr. 31: 14-9 | |
| 29 | WINER, R.L. et al.: N Engl. J. Med. 2006; 354: 2645-54 | |
| 30 | International Collaboration of Epidemiological Studies of Cervical Cancer: Lancet 2007; 370: 1601-21 | |
| 31 | HOGEWONING, C.J.A. et al.: Int. J. Cancer 2003: 107: 811-6 | |
| 32 | CASTELLSAGUÉ, X. et al.: N. Engl. J. Med. 2002; 346: 1105-12 | |
| 33 | SCHNEIDER, A. et al.: Int. J. Cancer (Pred. Oncol.) 2000; 89: 529-34 | |
| 34 | PETRY, K.U. et al.: Brit. J. Cancer 2003; 88: 1570-7 | |
| 35 | MARQUARDT, K. et al.: Frauenarzt 2007; 48: 1086-8 | |
| 36 | Epidemiologisches Krebsregister Niedersachsen (EKN): Krebs in Niedersachsen 2003. Registerstelle des EKN (Hrsg.), Niedersachsen 2006: 50-52 | |
| 37 | IARC: Handbooks of Cancer Prevention; Volume 10 - Cervix Cancer Screening; IARC Press, Lyon 2005 | |
| 38 | ÖSTÖR, A.: Int. J. Gynecol. Pathol. 1993; 12: 186-92 | |
| 39 | Deutsche Krebsgesellschaft e.V. (DKG)/Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG): Interdisziplinäre S2-Leitlinie für die Diagnostik und Therapie des Zervixkarzinoms. Stand 2004 [erstellt: 12/1999 (Verlängerung bis 09/2008)] http://www.uni-duesseldorf.de/awmf/ll/032-033.htm; Zugriff am 10. März 2008 | |
| 40 | HILLEMANNS, P. et al.: Zentralbl. Gynäkol. 2000; 122: 35-42 | |
| 41 | STOLER, M.H., SCHIFFMAN, M.: JAMA 2001; 285: 1500-5 | |
| 42 | COSTE, J. et al.: BMJ 2003; 326: 733 (6 Seiten) | |
| 43 | CUZICK, J. et al.: Int. J. Cancer 2006; 119: 1095-101 | |
| 44 | BECKER, N.: J. Cancer Res. Clin. Oncol. 2003; 129: 691-702 | |
| 45 | FAHEY, T. et al.: Am. J. Epidemiol. 1995; 141: 680-6 | |
| 46 | NANDA, K. et al.: Ann. Intern. Med. 2000; 132: 810-9 | |
| 47 | GUPTA, D.K. et al.: Acta Cytol. 2001; 45: 697-703 | |
| 48 | MDS - Medizinischer Dienst der Spitzenverbände der Krankenkassen e.V.: Gutachten: Altersgrenzen und Screeningintervalle in der Zervixcarcinom-Früherkennung mittels Pap-Test. Essen 2003 | |
| 49 | PETRY, K.U. et al.: Cost of screening and treatment of cervical dyscaryosis in Germany. Eur. J. Gynaecol. Oncol. 2008; in press | |
| 50 | Gemeinsamer Bundesausschuss: Teilbericht Früherkennung des Zervixkarzinoms, hier: - neue Technologien im Rahmen des Primärscreenings/Qualitätssicherung; Siegburg, 12. Mai 2007; http://www.g-ba.de/downloads/40-268-367/2007-06-05-Abschluss-Zervix.pdf; Zugriff am 10. März 2008 | |
| 51 | RAFFLE, A.E. et al.: BMJ 2003; 326: 901-4 | |
| 52 | NOCON, M. et al.: Welchen medizinischen und gesundheitsökonomischen Nutzen hat die Kolposkopie als primäres Screening auf das Zervixkarzinom? Deutsche Agentur für Health Technology Assessment des Deutschen Instituts für Medizinische Dokumentation und Information (DAHTA@DIMDI) [Hrsg.]: Köln, 2007 | |
| 53 | MAYRAND, M.H. et al.: N. Engl. J. Med. 2007; 357: 1579-88 | |
| 54 | SAWAYA, G.F. et al: N. Engl. J. Med. 2003; 349: 1501-9 | |
| 55 | GEISINGER, K.R. et al.: Am. J. Clin. Pathol. 2007; 128: 1010-4 | |
| 56 | MITTENDORF, T. et al.: HPV-DNA-Diagnostik zur Zervixkarzinomfrüherkennung. Deutsche Agentur für Health Technology Assessment des Deutschen Instituts für Medizinische Dokumentation und Information (DAHTA@DIMDI ) [Hrsg.]: Köln; 2007 http://gripsdb.dimdi.de/de/hta/hta_berichte/hta199_bericht_de.pdf; Zugriff am 10. März 2008 | |
| 57 | KYRGIOU, M. et al.: Lancet 2006: 367: 489-98 | |
| 58 | SADLER, L., SAFTLAS, A.: J. Perinat. Med. 2007; 35: 5-9 | |
| 59 | JAKOBSON, M. et al.: Obstetrics & Gynecology 2007; 109: 309-13 | |
| 60 | STRANDER, B. et al.: BMJ 2007: 335: 1077-82 | |
| 61 | Techniker Krankenkasse (Hrsg.): Sonderauswertung "Zervix 2006"; 2008 | |
| 62 | DRG Fallpauschalen-Katalog 2006; zu finden unter http://www.g-drg.de; Zugriff am 10. März 2008 | |
| 63 | BQS Leistungsbereich Gynäkologische Operationen; http://www.bqs-qualitätsindikatoren.de/2005/ergebnisse/leistungsbereiche/gynop; Zugriff am 7. Jan. 2008 | |
| 64 | ALTMAN, D. et al.: Lancet 2007; 370: 1494-9 | |
| 65 | Kassenärztliche Bundesvereinigung: Vereinbarung von Qualitätssicherungsmaßnahmen nach § 135 Abs. 2 SGB V zur zytologischen Untersuchung von Abstrichen der Cervix uteri (Qualitätssicherungsvereinbarung Zervix-Zytologie). Dt. Ärztebl. 2007; 104: A2446-51 | |
| 66 | SCHNEIDER, A. et al.: Geburtsh. Frauenheilk. 2007; 67: 859-65 | |
| 67 | FRANK, W. et al.: PAP-Test zum Screening auf Zervixkarzinom. Deutsche Agentur für Health Technology Assessment des Deutschen Instituts für Medizinische Dokumentation und Information (DAHTA@DIMDI) [Hrsg.]: Köln, 2005 http://gripsdb.dimdi.de/de/hta/hta_berichte/hta110_bericht_de.pdf; Zugriff am 10. März 2008 | |
| 68 | Zur HAUSEN, H.: zitiert in: Die Zeit (44): "Impfen gegen Krebs"; 26. Okt. 2006 | |
| 69 | PETRY, K.U.: zitiert in: Deutsches Ärzteblatt "Zervixkarzinom-Früherkennung: Bilanz muss besser werden": 2005; 102: A3392-4 | |
| 70 | HELLSTEN, C. et al.: BJOG 2008: 115: 212-8 | |
| 71 | ZECHMEISTER, I. et al.: Ökonomische Evaluation der Impfung gegen humane Papillomaviren (HPV-Impfung) in Österreich. HTA-Projektbericht Nr. 009, Wien 2007 http://eprints.hta.lbg.ac.at/760/2/HTA-Projektbericht_009.pdf; Zugriff am 10. März 2008 |
© 2008 arznei-telegramm, publiziert am 14. März 2008
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
