Mit mehrjähriger Verzögerung ist im Januar der Cox-2-Hemmer  Lumiracoxib (PREXIGE) eingeführt worden. Bereits 2002 hatte Novartis in den USA und Europa die Zulassung beantragt.1 Die damals
aufkommenden Erkenntnisse über die Kardiotoxizität der Stoffgruppe durchkreuzten die ursprüngliche Planung einer weltweiten
Markteinführung im Jahr 2003.2 Anders als in Großbritannien, dem Referenzstaat für die EU-Zulassung im Verfahren der gegenseitigen
Anerkennung,3 wird Lumiracoxib hierzulande nur in einer empfohlenen Dosierung (einmal täglich 100 mg) und nur für eine Indikation (Symptome
bei aktivierter Arthrose des Knie- und Hüftgelenks) angeboten.4 In den USA ist der Cox-2-Hemmer nach wie vor nicht im Handel. Lumiracoxib (PREXIGE) eingeführt worden. Bereits 2002 hatte Novartis in den USA und Europa die Zulassung beantragt.1 Die damals
aufkommenden Erkenntnisse über die Kardiotoxizität der Stoffgruppe durchkreuzten die ursprüngliche Planung einer weltweiten
Markteinführung im Jahr 2003.2 Anders als in Großbritannien, dem Referenzstaat für die EU-Zulassung im Verfahren der gegenseitigen
Anerkennung,3 wird Lumiracoxib hierzulande nur in einer empfohlenen Dosierung (einmal täglich 100 mg) und nur für eine Indikation (Symptome
bei aktivierter Arthrose des Knie- und Hüftgelenks) angeboten.4 In den USA ist der Cox-2-Hemmer nach wie vor nicht im Handel.
EIGENSCHAFTEN: Lumiracoxib ist chemisch eng verwandt mit Diclofenac (VOLTAREN u.a.). Es unterscheidet sich von Diclofenac nur
durch eine zusätzliche Methylgruppe sowie durch Austausch eines der beiden Chlorsubstituenten am Phenylring durch ein Fluoratom. Es gilt als selektivster
unter den verfügbaren Cox-2-Hemmern.5
Das Mittel wird nach Einnahme per os rasch absorbiert mit einer Bioverfügbarkeit von 74%. Es wird in der Leber nahezu vollständig metabolisiert, unter
anderem über CYP 2C9, was jedoch nicht der Hauptabbauweg zu sein scheint. Das Interaktionspotenzial von Lumiracoxib mit Substraten von CYP 2C9 soll
gering sein. Vorsicht ist jedoch geboten, wenn gleichzeitig CYP 2C9-Substrate mit geringer therapeutischer Breite angewendet werden, wie zum Beispiel Warfarin
(COUMADIN u.a.). Bei Patienten, die gleichzeitig orale Antikoagulanzien einnehmen, muss daher die Gerinnung überwacht werden, insbesondere bei
Therapiebeginn mit Lumiracoxib oder Dosisänderung.4
Die Plasmahalbwertszeit ist mit vier Stunden4 relativ kurz. Ähnlich anderen nichtsteroidalen Antirheumatika wie Diclofenac sind die Lumiracoxibspiegel
in der Gelenkflüssigkeit länger erhöht als im Plasma, was möglicherweise eine über die kurze Plasmahalbwertszeit hinausgehende
Wirkdauer erklärt.6
KLINISCHER NUTZEN: In zwei identisch angelegten 13-wöchigen randomisierten Studien mit insgesamt 3.235 Patienten wirkt Lumiracoxib in der
empfohlenen Dosierung von einmal täglich 100 mg auf Schmerzen, Krankheitsaktivität nach Einschätzung der Patienten und WOMAC-Index* bei
symptomatischer Kniearthrose signifikant besser als Plazebo und ähnlich wie einmal täglich 200 mg Celecoxib (CELEBREX).7,8
* |
WOMAC-Index = Western Ontario und MacMasters Universities Osteoarthritis Index, Fragebogen zur Erfassung
von Schmerzen, Funktion und Steifigkeit bei Arthrose
|
Veröffentlichte Studien zum Nutzen der empfohlenen Lumiracoxibdosis bei Hüftarthrose oder im Vergleich mit herkömmlichen NSAR finden wir nicht.
In einer vierwöchigen Dosisfindungsstudie9 mit 583 Patienten mit Hüft- oder Kniearthrose wirken täglich 150 mg Diclofenac nach einer
Woche signifikant besser analgetisch als zweimal täglich 50 mg oder zweimal täglich 100 mg Lumiracoxib.10 Bei Patienten mit rheumatoider
Arthritis - keine zugelassene Indikation - lindert in einer weiteren Dosisfindungsstudie nach vier Wochen nur noch Diclofenac Schmerzen signifikant besser als
Plazebo, nicht aber der Cox-2-Hemmer in Dosierungen von zweimal täglich 50 mg bis einmal täglich 400 mg.11 Die Effektivität der
empfohlenen Lumiracoxibdosierung ist nach Auffassung der US-amerikanischen Arzneimittelbehörde FDA bislang nicht zufriedenstellend nachgewiesen.12
UNERWÜNSCHTE EFFEKTE: Die gastrointestinale Sicherheit von Lumiracoxib wird in der 2004 publizierten TARGET**-Studie
geprüft.13,14 TARGET besteht aus zwei Substudien mit insgesamt 18.325 durchschnittlich 63 Jahre alten Arthrosepatienten, in denen der Cox-2-
Hemmer einerseits mit Ibuprofen (IBU-1A PHARMA u.a.), andererseits mit Naproxen (PROXEN u.a.) verglichen wird. Lumiracoxib ist mit täglich 400 mg vierfach
höher dosiert als jetzt empfohlen, Ibuprofen (täglich 2.400 mg) und Naproxen (täglich 1.000 mg) sind maximal bzw. fast maximal dosiert. Primärer
Endpunkt sind obere gastrointestinale Ulkuskomplikationen wie Blutung, Perforation oder Obstruktion. Darüber hinaus ist die TARGET-Studie auch auf
Prüfung der kardiovaskulären, hepatischen und renalen Sicherheit angelegt. Primärer kardiovaskulärer Endpunkt ist die Kombination aus
Herzinfarkt, Schlaganfall oder kardiovaskulär bedingtem Tod. Die Studie ist jedoch in dieser Frage für den Vergleich mit Naproxen, das beim derzeitigen
Kenntnisstand im Hinblick auf kardiovaskuläre Risiken die sicherste Wahl ist (a-t 2007; 38: 1-3), nicht hinreichend
gepowert.15
** |
TARGET = Therapeutic Arthritis Research and Gastrointestinal Event Trial
|
Trotz Teilnahme von Patienten mit hohem Risiko für Ulkuskomplikationen - z.B. 3% mit Ulkus oder Blutungen in der Vorgeschichte, 11% sind 75 Jahre oder
älter - sind als Magenschutz nur Antazida und die Kurzzeitanwendung niedrig dosierter H2-Antagonisten erlaubt. Misoprostol (CYTOTEC Eurim Pharm u.a.)
ist offenbar nicht vorgesehen, Protonenpumpenhemmer sind nicht erlaubt.15 Rund 40% der Patienten brechen die auf ein Jahr angelegte Studie vorzeitig
ab.13,14 Sie werden bis auf einen Anruf vier Wochen nach ihrem Ausscheiden offenbar nicht weiter nachbeobachtet.13-15
ZUM MAGENSCHUTZ BEI EINNAHME
NICHTSTEROIDALER ANTIRHEUMATIKA
Als Mittel der ersten Wahl zur Prävention von Magen-Darm-Schäden unter Einnahme nichtsteroidaler Antirheumatika (NSAR) haben wir bislang das
Prostaglandinderivat Misoprostol (CYTOTEC, Eurim Pharm u.a.) den Protonenpumpenhemmern vorgezogen (a-t 2007; 38:
1-2). Diese Einstufung beruht auf einer 1995 publizierten randomisierten Studie, nach der Misoprostol im Verlauf von bis zu sechs Monaten die Rate
schwerer Ulkuskomplikationen wie Blutungen unter NSAR-Einnahme senkt (0,57% vs. 0,95% unter Plazebo; Number needed to treet [NNT] = 263),1
ein Nutzen, der für Protonenpumpenhemmer nicht belegt ist (a-t 2000; 31: 91-2, 97). Bei erneuter
Überprüfung überwiegen jedoch die Zweifel an der Aussagekraft dieser Studie. Zahlreiche Patienten haben die Untersuchung vorzeitig
abgebrochen, unter Misoprostol signifikant mehr als unter Plazebo (42% vs. 36%). Auch die Rate der Patienten, die die Studie wegen unerwünschter Effekte,
darunter auch Bauchschmerzen, vorzeitig beenden, ist unter Misoprostol signifikant höher (insgesamt: 27,5% vs. 20,2%; Number needed to harm [NNH] = 14;
Bauchschmerzen: 6,4% vs. 4,8%, NNH = 63).1 Auf Nachfrage teilt uns die Firma Pfizer, die die Studiendaten verwaltet, mit, dass Studienabbrecher nach der
vorzeitigen Abschlussvisite nicht weiter nachbeobachtet wurden. Schwerwiegende Komplikationen wurden innerhalb von 30 Tagen nach vorzeitiger Beendigung
zwar noch erfasst, aber nur sofern sie dem Studienzentrum bekannt wurden. Eine aktive Nachbeobachtung gab es nicht.2 Vor diesem Hintergrund
lässt sich nicht ausschließen, dass sich in dem Studienergebnis nicht (allein) der Nutzen von Misoprostol spiegelt, sondern die Selektion robusterer
Patienten durch das schlecht verträgliche Prostaglandinderivat. Es könnte sein, dass kränkere und stärker gefährdete Patienten
Misoprostol eher absetzen, während die gesünderen die langfristige Einnahme eher durchhalten. Da die Komplikationsrate jedoch nicht nach Intention to
treat, sondern nur unter den Patienten mit Compliance erhoben wurde, könnte das Ergebnis zu Gunsten von Misoprostol verzerrt sein.
Eine Senkung der durch endoskopisches Screening entdeckten peptischen Ulzera unter Einnahme von NSAR ist sowohl für Misoprostol als auch
für Protonenpumpenhemmer beschrieben.3 Da ein Vorteil von Misoprostol im Hinblick auf Ulkuskomplikationen aufgrund der Zweifel an der
Validität der Studie nicht gesichert ist, erachten wir die Protonenpumpenhemmer bei Bedarf für einen Magenschutz unter NSAR-Einnahme als dem
Misoprostol ebenbürtig, aufgrund der besseren Verträglichkeit und der geringeren Kosten aber für geeigneter. In der Praxis haben sie sich ohnehin
durchgesetzt.
| | | (R=
randomisierte Studie, M = Metaanalyse)
|
R |
1 |
SILVERSTEIN, F.E. et al.: Ann. Intern. Med. 1995; 123: 241-9 |
| |
2 |
VERBURG, K.M. (Pfizer): Schreiben vom 10. Febr. 2007 |
M |
3 |
ROSTOM, A. et al.: Prevention of NSAID-induced gastroduodenal ulcers. The Cochrane
Database of Systematic Reviews 2007, Issue 1; Stand Juli 2002 |
|
Lumiracoxib senkt die Rate derUlkuskomplikationen gegenüber Ibuprofen und Naproxen im Studienzeitraum von 0,91% auf 0,32% (Hazard Ratio
[HR] 0,34; 95% Konfidenzintervall [CI] 0,22-0,52; NNT = 169). In der Subgruppe der Patienten, die niedrig dosierte Azetylsalizylsäure (ASS; ASPIRIN u.a.)
einnehmen (24%), ist der Vorteil deutlich geringer und nicht mehr signifikant (0,69% unter Lumiracoxib vs. 0,88%; HR 0,79; 95% CI 0,40-1,55).13
Kardiovaskuläre Komplikationen nehmen unter dem Cox-2-Hemmer dagegen numerisch zu (0,65% vs. 0,55%; HR 1,14; 95% CI 0,78-1,66). Der Unterschied
zwischen Lumiracoxib und Naproxen ist deutlicher, wenngleich ebenfalls nicht signifikant (jährlich 0,84% vs. 0,57%; HR 1,46; 95% CI 0,89-2,37), sowohl bei den
Nicht-ASS-Anwendern (HR 1,49; 95% CI 0,76-2,92) als auch bei den ASS-Anwendern (HR 1,42; 95% CI 0,70-2,90). Im Vergleich zu Ibuprofen ist die Rate unter
Lumiracoxib dagegen numerisch geringer (HR 0,76; 95% CI 0,41-1,40), insbesondere bei den ASS-Anwendern (HR 0,56 [0,20-1,54]). Der Blutdruck steigt
unter herkömmlichen NSAR signifikant stärker als unter Lumiracoxib. Nierenschädigung, definiert als Verdoppelung des Serumkreatinins
oder Proteinurie von mindestens 3 g/l, kommt andererseits unter Lumiracoxib numerisch häufiger vor (0,51% vs. 0,37%; HR 1,34; 95% CI 0,86-
2,10).13
Ähnlich wie Diclofenac kann Lumiracoxib die Leber schädigen: Transaminasenanstiege auf mehr als das Dreifache der oberen Norm sind mit 2,57% vs.
0,63% signifikant häufiger als unter den Vergleichs-NSAR. Auch schwerwiegende Leberschäden wie Hepatitis kommen mit 0,07% vs. 0,03% numerisch
häufiger vor.13 Unter der jetzt empfohlenen Dosis von täglich 100 mg Lumiracoxib wird Transaminasenanstieg auf mehr als das Dreifache der
oberen Norm in klinischen Studien bei 1%, auf mehr als das Achtfache bei 0,2% der Anwender beobachtet.4
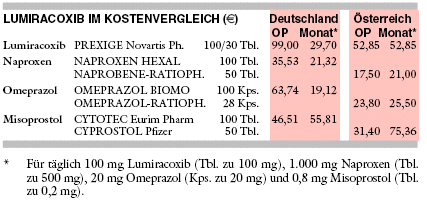
KOSTEN: Lumiracoxib (PREXIGE) verteuert mit monatlich 30 € für täglich 100 mg die Behandlung der aktivierten Arthrose im Vergleich zu
einem preiswerten Naproxengenerikum (z.B. NAPROXEN HEXAL; 21 €/Monat für täglich 1.000 mg) um 40%. Die Kombination von Naproxen mit
Omeprazol (z.B. OMEPRAZOL BIOMO; monatlich 19 € für täglich 20 mg) bei hohem Risiko für Ulkuskomplikationen ist mit monatlich 40
€etwa 40% teurer als Lumiracoxib.
 Der seit Januar angebotene Cox-2-Hemmer Der seit Januar angebotene Cox-2-Hemmer  Lumiracoxib (PREXIGE) lindert in der zugelassenen Dosierung von einmal täglich 100 mg
Schmerzen bei Kniearthrose besser als Plazebo. Lumiracoxib (PREXIGE) lindert in der zugelassenen Dosierung von einmal täglich 100 mg
Schmerzen bei Kniearthrose besser als Plazebo.
 Die Wirksamkeit bei Hüftarthrose ist mangels auffindbarer Studien nicht
beurteilbar. Die Wirksamkeit bei Hüftarthrose ist mangels auffindbarer Studien nicht
beurteilbar.
 Gleichwertigkeit mit herkömmlichen nichtsteroidalen Antirheumatika (NSAR)
ist nicht belegt. Es gibt dagegen Hinweise auf schwächere Wirksamkeit von Lumiracoxib im Vergleich zu klassischen NSAR. Gleichwertigkeit mit herkömmlichen nichtsteroidalen Antirheumatika (NSAR)
ist nicht belegt. Es gibt dagegen Hinweise auf schwächere Wirksamkeit von Lumiracoxib im Vergleich zu klassischen NSAR.
 Der Cox-2-Hemmer senkt in der TARGET-Studie im Vergleich mit
herkömmlichen NSAR die Rate der Ulkuskomplikationen. Bei gleichzeitiger Einnahme von Azetylsalizylsäure (ASPIRIN u.a.) ist kein signifikanter
Unterschied mehr nachweisbar. Da Risikopatienten nicht vollständig ausgeschlossen wurden, ein bei diesen Patienten angezeigter wirksamer Magenschutz
aber nicht vorgesehen oder sogar verboten war, bleibt die Übertragbarkeit der Ergebnisse auf leitliniengerecht behandelte Patienten offen. Der Cox-2-Hemmer senkt in der TARGET-Studie im Vergleich mit
herkömmlichen NSAR die Rate der Ulkuskomplikationen. Bei gleichzeitiger Einnahme von Azetylsalizylsäure (ASPIRIN u.a.) ist kein signifikanter
Unterschied mehr nachweisbar. Da Risikopatienten nicht vollständig ausgeschlossen wurden, ein bei diesen Patienten angezeigter wirksamer Magenschutz
aber nicht vorgesehen oder sogar verboten war, bleibt die Übertragbarkeit der Ergebnisse auf leitliniengerecht behandelte Patienten offen.
 Die TARGET-Studie begründet Zweifel an der kardiovaskulären
Sicherheit von Lumiracoxib, das mit einer zumindest numerisch höheren Rate kardiovaskulärer Komplikationen als Naproxen (PROXEN u.a.) einhergeht.
Dass das Ergebnis in dem für diese Frage unzureichend gepowerten Studienarm nicht signifikant ist, darf nicht als Beleg für die Unbedenklichkeit von
Lumiracoxib gewertet werden. Die TARGET-Studie begründet Zweifel an der kardiovaskulären
Sicherheit von Lumiracoxib, das mit einer zumindest numerisch höheren Rate kardiovaskulärer Komplikationen als Naproxen (PROXEN u.a.) einhergeht.
Dass das Ergebnis in dem für diese Frage unzureichend gepowerten Studienarm nicht signifikant ist, darf nicht als Beleg für die Unbedenklichkeit von
Lumiracoxib gewertet werden.
 Mittel der Wahl bei Indikation für eine langfristige Einnahme von NSAR bleibt
Naproxen. Bei hohem Risiko für Ulkuskomplikationen soll zusätzlich ein Protonenpumpenhemmer oder Misoprostol (CYTOTEC Eurim Pharm u.a.)
eingenommen werden (siehe Kasten). Mittel der Wahl bei Indikation für eine langfristige Einnahme von NSAR bleibt
Naproxen. Bei hohem Risiko für Ulkuskomplikationen soll zusätzlich ein Protonenpumpenhemmer oder Misoprostol (CYTOTEC Eurim Pharm u.a.)
eingenommen werden (siehe Kasten).
|

