SIMVASTATIN (ZOCOR U.A.) GENERISCH - |
Im Mai läuft auch in Deutschland das Patent des Cholesterin-Synthese (CSE)-Hemmers Simvastatin (ZOCOR u.a.) ab, im Juni das von Lovastatin
(MEVINACOR). Bei einem Gesamtverordnungsvolumen von mehr als 1,4 Milliarden Euro (Apothekenabgabepreise) für CSE-Hemmer gerät ein
beträchtliches Marktsegment in Bewegung. Simvastatin ist mit 415 Millionen (Mio.) Euro Jahresumsatz bezogen auf die Marktbedeutung hinter Atorvastatin
(SORTIS) der zweitwichtigste CSE-Hemmer, was die Absicherung des klinischen Nutzens betrifft jedoch der wichtigste. 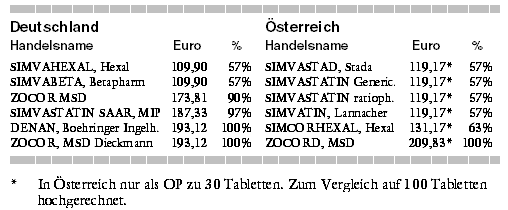
Nur drei der fünf angebotenen CSE-Hemmer (Simvastatin, Pravastatin und Lovastatin) sind in randomisierten kontrollierten Langzeitstudien
mit "harten" klinischen Endpunkten wie Herzinfarktrate geprüft. Simvastatin und Pravastatin wirken bei Patienten mit manifesten atherosklerotischen
Erkrankungen nachweislich lebensverlängernd (a-t 1998; Nr. 7: 66). Simvastatin kommt eine Sonderstellung zu,
da es in der größten randomisierten Interventionsstudie, der 2002 veröffentlichten Heart Protection Study (HPS), nicht nur das Risiko koronarer
Ereignisse verringert, sondern auch die Gefahr ischämischer Schlaganfälle und peripherer revaskularisierender Eingriffe (a-t 2002; 33: 83-4). 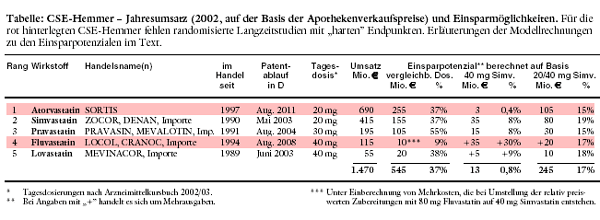
Zwei Argumente dürften bislang wesentlich dazu beigetragen haben, dass Atorvastatin mit 690 Mio. Euro/Jahr der meistverkaufte CSE-Hemmer ist,
obwohl er erst seit 1997 auf dem Markt ist: der bislang relativ günstige Preis und der als besonders stark beworbene Cholesterin-senkende Effekt. Das
Kostenargument entfällt jetzt. Die neuen Simvastatin-Produkte sind 37% preiswerter, wenn identische Wirkstoffmengen verglichen werden. Selbst wenn man
Simvastatin 50% höher dosieren würde als Atorvastatin, bleibt ein Kostenvorteil von 6% (40 Mio. €/Jahr weniger) für Simvastatin. Die
stärkere Cholesterinsenkung unter Atorvastatin - und auch unter dem noch nicht eingeführten Rosuvastatin (CRESTOR; s. Seite 32) - erscheint nach HPS irrelevant: Der Nutzen von Simvastatin ist hier unabhängig von der Cholesterinsenkung. Die in
der Werbung für Atorvastatin herausgestellte Studie mit LDL-Cholesterin-Senkung "bis zu 51%"1 entpuppt sich ohnehin als unbedeutend.
Dieser Wert - wie auch die ebenfalls beworbene Triglyzerid-Senkung "bis zu 32%"1 - beruht auf Daten von lediglich 61 Personen einer offenen
Acht-Wochenstudie2 ohne Bezug zu klinischen Langzeitbefunden. Nach der HPS gelten 40 mg Simvastatin pro Tag als Goldstandard. Würde bei einer Umstellung aller CSE-Hemmer auf Simvastatin konsequent die 40-mg-
Dosis gewählt, würden die Einsparungen fast wieder aufgezehrt, weil häufig Dosissteigerungen erforderlich wären:
Da hoch dosierte CSE-Hemmer von einem Teil der Patienten nicht toleriert werden (z.B. Myopathien), gehen wir in einer weiteren Modellrechnung zwar
von einer anzustrebenden Tagesdosis von 40 mg Simvastatin aus, berechnen jedoch alle CSE-Hemmer-Dosierungen, deren äquivalenzdosis unter 20 mg
Simvastatin liegt, nur mit 20 mg Simvastatin pro Tag. Diese Dosis liegt im unteren Bereich der Dosierungen (20-40 mg, im Mittel 27 mg), für die im Rahmen der 4
-S-Studie ein Nutzen auf der Basis "harter" Kriterien dokumentiert ist (a-t 1996; Nr. 8: 75-6). 
|
| © 2003 arznei-telegramm |
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
