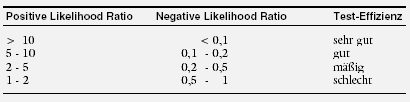Die Mammographie gilt als Methode der Wahl zur Früherkennung des Mammakarzinoms, der häufigsten
Krebserkrankung der Frau. Von Fach- und Laienpresse verbreitete Meldungen - "jede zehnte Frau ... trifft es" (Stern vom 7. Okt. 1999), "Reduktion
der Mortalität" durch Mammographie "bis 30%" (MAYOR, S.: Brit. Med. J. 318 [1999], 621) - geben den Kenntnisstand nur ausschnittsweise wieder
und erscheinen nicht hilfreich, Krebsgefährdung bzw. Erfolgswahrscheinlichkeit der Diagnostik zu beurteilen.
Zum ersten Mal wird in dem folgenden Übersichtsartikel versucht, den Kenntnisstand so aufzubereiten, dass zusammen mit der Frau eine objektive Einschätzung des
möglichen persönlichen Nutzens im Verhältnis zu Aufwand und Nebenwirkungen möglich wird. Aufbereitung und Darstellung der Datenlage für wissenschaftsbasierte
Patienten- beziehungsweise Konsumenten-Entscheidungen ("evidencebased patient/consumer choice") gehen weit über das hinaus, was bislang für
Einwilligungserklärungen üblich ist.
MAMMOGRAPHIE-SCREENING -
DARSTELLUNG DER WISSENSCHAFTLICHEN
EVIDENZ-GRUNDLAGE
ZUR KOMMUNIKATION MIT DER FRAU
Ingrid MÜHLHAUSER, Birgitt HÖLDKE*
Empfehlungen zum Mammographie-Screening
Die Deutsche Röntgengesellschaft hat auf ihrem im Mai 1999 abgehaltenen 80. Kongress in Wiesbaden die regelmäßige Mammographie zur Früherkennung von
Brustkrebs für Frauen vom 40. bis 70. Lebensjahr gefordert.33 Vom 40. bis 50. Lebensjahr soll jährlich, danach im Abstand von ein bis zwei Jahren eine
Mammographie durchgeführt werden. Dadurch soll die Sterblichkeit an Brustkrebs um 30% reduziert werden.
Bisher gibt es in Deutschland kein qualitätsgesichertes Brustkrebs-Früherkennungsprogramm, und die Mammographie zur Früherkennung von Brustkrebs im Sinne
eines bevölkerungsweiten Screenings gesunder Frauen wird von den gesetzlichen Krankenkassen nicht bezahlt. Trotzdem werden nach Schätzungen pro Jahr
etwa fünf Millionen sog. verdeckte Mammographie-Screening-Untersuchungen durchgeführt.
Einem Beschluss des Bundesausschusses der Ärzte und Krankenkassen zufolge soll Anfang des Jahres 2000 in drei Regionen Deutschlands das Mammographie-
Screening für Frauen ab dem 50. Lebensjahr als Modellprojekt eingeführt werden.
Die Mammographie als Screening-Untersuchung zur Früherkennung von Brustkrebs ist eine nach wissenschaftlichen Kriterien sehr gut untersuchte Intervention. Es
liegen dazu acht große randomisierte kontrollierte Studien mit insgesamt etwa 500.000 Frauen und Beobachtungszeiten bis zu 18 Jahren aus den USA, Schweden,
Schottland und Kanada vor. Die Ergebnisse wurden in mehreren Metaanalysen8,20,21,30,41-43 und HTA (Health Technology Assessment)-Berichten
aufgearbeitet.13
Für Frauen im Alter zwischen 50 und 70 Jahren ergaben die Metaanalysen eine statistisch signifikante Reduzierung der Brustkrebs-Sterblichkeit als Folge der
Mammographie-Screening-Programme um 25% bis 30% nach 5 bis 6 Jahren. Für Frauen zwischen 40 und 49 Jahren war nach 7 bis 9 Jahren Beobachtungszeit
keine statistisch signifikante Verminderung der Brustkrebs-Sterblichkeit nachzuweisen.
Erst nach Beobachtungszeiten von 10 bis 14 Jahren kommt eine gemeinsame Auswertung aller Studien zu einer Reduzierung der Brustkrebs-Sterblichkeit um 16%
(95% Konfidenzintervalle 1%-29%).21 Für Frauen jünger als 40 Jahre bzw. älter als 70 Jahre liegen bisher keine entsprechenden Untersuchungen
vor.
Die Empfehlungen nationaler und internationaler Fachgremien und Experten sind nicht einheitlich.38,44 Für Frauen zwischen dem 40. und 50. Lebensjahr wird von
einem Mammographie-Screening meist abgeraten.29
Informierte Konsumenten-Entscheidungen
Mit der Entwicklung der Evidenz (Wissenschafts)-basierten Medizin (EBM) (im Gegensatz zur Experten-/Meinungsbildner-/Marketing-basierten Medizin) wurde die
Forderung verstärkt, Patienten bzw. Konsumenten sog. informierte Entscheidungen ("informed decision making") zu Krankheitsbzw. Gesundheits-
relevanten Fragen zu ermöglichen.7,34 Mehr Information für Patienten und Konsumenten als Grundlage zur Entscheidungsfindung wird auch zunehmend
von der Öffentlichkeit gefordert. In England wurde hierzu ein nationales Programm initiiert.7
Informierte Entscheidungen können Patienten oder Konsumenten jedoch nur treffen, wenn sie wissenschaftliche Ergebnisse interpretieren und bewerten können.
Das "General Medical Council" der britischen Ärzteschaft hat kürzlich Leitlinien zur Ethik in Bezug auf diagnostische Eingriffe einschließlich Screening-
Untersuchungen veröffentlicht.12 Die Leitlinien empfehlen ausdrücklich, dass vor dem Eingriff der Zweck der Untersuchung erklärt werden soll,
einschließlich der Wahrscheinlichkeiten für falsch negative und falsch positive Ergebnisse, Unsicherheiten und Risiken der Untersuchung, wichtige medizinische,
soziale und finanzielle Folgen des Screenings, die Planung des weiteren Verfahrens einschließlich der Nennung von Beratungs- und Unterstützungsangeboten. Auch
Interessenskonflikte, z.B. finanzieller Art, und die bewusste Zurückhaltung von Information, die für eine informierte Entscheidung notwendig wäre, sollten offen gelegt
werden. Es müsste ausreichend Zeit für Überlegungen sein, sich für oder gegen eine Teilnahme an der Untersuchung zu entscheiden. Die Wahrscheinlichkeit, dass
ein Patient oder Konsument die Zustimmung zur Untersuchung nach voller Information ablehnt, darf kein Grund sein, die Informationen nicht zu geben.
Wissenschaftsbasierte Patienten- bzw. Konsumenten-Entscheidungen ("evidence-based patient/consumer choice") gehen weit über das hinaus, was
bisher unter Patientenmitbestimmung, z.B. bei Einwilligungen zu diagnostischen Maßnahmen oder Therapie-Entscheidungen, verstanden wurde. Bei der traditionellen
Mitentscheidung war der Laie auf Bewertungen von Experten angewiesen. Entscheidungen wurden getroffen unter Abwägung der Glaubwürdigkeit der jeweiligen
Experten und eigener Präferenzen. Traditionelle Experten-Bewertungen durch Ärzte, Medizin-Journalisten u.a. beschränken sich auf Globalurteile, wie "das ist
bewiesen", "es ist besser, zu behandeln", "Früherkennungsuntersuchungen retten Menschenleben" oder einer verzerrten Darstellung
wissenschaftlicher Daten. Eine objektive Einschätzung eines möglichen persönlichen Nutzens im Verhältnis zu Aufwand und Nebenwirkungen war dem Laien bisher
so nicht möglich.
Darstellung wissenschaftlicher Daten
Die Art und Weise, wie wissenschaftliche Daten präsentiert werden ("framing of data"), beeinflusst die Entscheidungen von Ärzten und
Patienten.5,10,11,15,23
Üblicherweise werden Therapie-Erfolge als relative Risikoreduktionen dargestellt, wie z.B. "Brustkrebs-Früherkennungsuntersuchungen vermindern die
Sterberate an Brustkrebs um 30%". Diese Darstellung impliziert bei oberflächlicher Interpretation fälschlicherweise, dass je 100 Frauen 30 weniger an Brustkrebs
sterben.23 Demgegenüber werden Angaben in Absolutzahlen sowohl von Ärzten als auch von Laien den Angaben in Relativ-Prozent
vorgezogen.14
Eine objektive Darstellung wissenschaftlicher Ergebnisse aus Präventions- oder Therapiestudien erfordert nicht nur die Darstellung eines möglichen Nutzens,
sondern mit gleicher Wertigkeit auch das Fehlen eines Nutzens bzw. möglicher Schäden der jeweiligen Intervention. Solche umfassenden Darstellungen werden
zunehmend gefordert.14,40 Bisher wurden sie jedoch nur selten und ansatzweise angewandt.1,24,26,27,37,36 Der vorliegende Artikel versucht,
die wis-
senschaftliche Evidenz zu wesentlichen Aspekten der Mammographie als Screening-Methode darzustellen. Damit soll eine Grundlage zur Kommunikation mit
interessierten Frauen geschaffen werden.
Effekt von Früherkennungsuntersuchungen mit Mammographie auf die Brustkrebs-Mortalität
Das primäre Ziel von Mammographie-Screening-Untersuchungen ist die Verminderung der Mortalität, optimalerweise der Gesamtmortalität, aber zumindest der
Mortalität an Brustkrebs, bei akzeptablem Verhältnis zu Lebensqualität, Aufwand und Kosten.
Im Folgenden werden daher zuerst die Ergebnisse bezüglich der Sterberate an Brustkrebs dargestellt. Die benutzten Daten sind aus einer Übersicht der vier
schwedischen Mammographie-Studien entnommen.30 Diese Arbeit wurde gewählt, da sie die Rohdaten zur Brustkrebs-Sterblichkeit und
Gesamtsterblichkeit ausreichend genau mitteilt. Zwischen 1976 und 1984 wurden Frauen im Alter zwischen 40 und 74 Jahren, bei denen kein Brustkrebs bekannt
war, zu zwei bis fünf Screening-Runden im Abstand von 18 bis 33 Monaten eingeladen (Interventionsgruppe "mit Mammographie") bzw. nicht zu solchen
Mammographien eingeladen (Kontrollgruppe "ohne Mammographie"). Die Teilnahmerraten für die ersten Screening-Runden lagen zwischen 74% und 89%.
Die Beobachtungszeiten betrugen 7 bis 15 Jahre. Der Auswertung lagen für die Interventionsgruppe (156.911 Frauen) 1.429.910 Personenjahre zugrunde und für
die Kontrollgruppe (125.866 Frauen) 1.138.870 Personenjahre. Das relative Risiko der Interventionsgruppe im Vergleich zur Kontrollgruppe für Tod durch Brustkrebs
betrug 0,80 mit 95% Konfidenz-Intervallen zwischen 0,70 und 0,92. Dies bedeutet eine statistisch signifikante relative Risikoreduktion von 20% infolge der
Mammographie-Screening-Programme.
Tabelle 1 zeigt verschiedene Möglichkeiten, dieses Ergebnis zur Brustkrebs-Mortalität darzustellen. Die Daten werden entweder als Absolutzahlen, relatives oder
absolutes Risiko angegeben. Die Darstellung betont entweder den Anteil der Personen, die einen Nutzen durch Mammographie-Screening haben oder den Anteil der
Personen, die keinen Nutzen haben.
Die Darstellung der Risikoreduktion in Relativprozent wird am häufigsten benutzt. Sie findet sich sowohl in der Laienpresse als auch in medizinisch-
wissenschaftlichen Journalen. Die Darstellung der Ergebnisse als Absolutprozent wird in wissenschaftlichen Zeitschriften zunehmend gefordert. Die übrigen Arten der
Darstellung werden selten1,5,24,26,27,37 oder gar nicht benutzt, wie die Angabe der prozentualen Zunahme (relativ oder absolut) des Anteils der Personen,
die das Ereignis (Tod durch Brustkrebs) nicht erleiden, oder die Angabe des Anteils der Personen mit dem Ereignis, die dieses trotz der Intervention erleiden. Man
stelle sich folgende medizinische Erfolgsmeldung vor: "Durch Mammographie-Früherkennungsuntersuchungen kann der Anteil der Frauen, die nicht an
Brustkrebs sterben, um sieben Zehntausendstel erhöht werden." Eine solche Meldung wird man vermutlich niemals hören. Und doch wäre diese Mitteilung
vergleichbar korrekt wie die Meldung, dass durch Mammographie-Früherkennungsuntersuchungen die Sterblichkeit an Brustkrebs, wie in den schwedischen
Studien, um 20% vermindert werden kann.

Tabelle 2: Wie gut können Früherkennungsuntersuchungen mit Mammographie Tod durch Brustkrebs
verhindern? Untersuchungen aus Schweden zeigen:20,30
- Ohne Mammographie-Früherkennungsuntersuchungen sterben in einem Zeitraum von zehn Jahren 4 von 1.000 Frauen an Brustkrebs.
- Mit Mammographie-Früherkennungsuntersuchungen sterben in einem Zeitraum von zehn Jahren 3 von 1.000 Frauen an Brustkrebs.
Anders dargestellt:
- Ohne Mammographie-Früherkennungsuntersuchungen sterben in einem Zeitraum von zehn Jahren 996 Frauen nicht an Brustkrebs.
- Mit Mammographie-Früherkennungsuntersuchungen sterben in einem Zeitraum von zehn Jahren 997 Frauen nicht an Brustkrebs.
Oder:
- Von 1.000 Frauen mit Mammographie-Früherkennungsuntersuchungen über zehn Jahre hat 1 Frau insofern einen Nutzen, als sie in dieser Zeit nicht an
Brustkrebs stirbt.
- Von 1.000 Frauen mit Mammographie-Früherkennungsuntersuchungen über zehn Jahre haben 999 Frauen keinen Nutzen, da sie auch ohne Mammographie-Früherkennungsuntersuchungen nicht an Brustkrebs gestorben wären (996 Frauen) oder weil sie trotz Mammographie-Früherkennungsuntersuchungen an
Brustkrebs gestorben sind (3 Frauen).
Weitere Möglichkeiten der Darstellung von Ergebnissen aus Interventions-Studien sind die "Number Needed to Treat" (NNT, vgl. a-t 5 [1998], 47) bzw. "Number Needed to Screen" (Anzahl der Personen, die behandelt beziehungsweise
gescreent werden müssen, um ein Endpunktereignis zu verhindern)34 oder die Angabe der mittleren Lebensverlängerung in Tagen, Wochen oder
Monaten.
Nach den schwedischen Studien müssten etwa 1.000 Frauen zehn Jahre lang mammographiert werden, um in diesem Zeitraum einen Fall von Tod durch Brustkrebs
zu verhindern. Für Mammographie-Screeninguntersuchungen von Frauen vom 50. bis zum 69. Lebensjahr wurde eine durchschnittliche Lebensverlängerung von 12
Tagen pro Frau errechnet. Bei Beginn des Screenings ab dem 40. Lebensjahr beträgt die errechnete durchschnittliche Lebensverlängerung 2,5 Tage pro
Frau.35
Um eine informierte Konsumenten-Entscheidung zu ermöglichen, müssen beide Aspekte - möglicher Nutzen sowie möglicher Nicht-Nutzen - gleichwertig dargestellt
werden. Tabelle 2 zeigt ein Beispiel zur quantitativen schematisierten Darstellung der Ergebnisse aus Tabelle 1 als mögliche Grundlage zur Kommunikation mit den
Frauen.
Effekt von Früherkennungsuntersuchungen mit Mammographie auf die Gesamtsterblichkeit
Tabelle 3 gibt eine Darstellung von Daten zur Gesamtmortalität (alle Todesursachen). Die Ergebnisse beziehen sich ebenfalls auf die Auswertung der
schwedischen Studien.30

Da die Unterschiede zwischen den Gruppen mit und ohne Mammographie nicht statistisch signifikant sind, könnte man vereinfachend folgendermaßen
formulieren:
- Im Laufe von zehn Jahren sterben gleich viele Frauen, egal ob Mammographien zur Früherkennung von Brustkrebs angeboten werden oder nicht.
- Ohne Mammographie-Früherkennungsuntersuchungen sind von 100 verstorbenen Frauen 4 an Brustkrebs, 96 an anderen Todesursachen verstorben.
- Mit Mammographie-Früherkennungsuntersuchungen sind von 100 verstorbenen Frauen 3 an Brustkrebs, 97 an anderen Todesursachen verstorben.
Eine vollständigere Beurteilung des möglichen Nutzens bzw. Schadens von Mammographie-Screening erfordert die Berücksichtigung wissenschaftlicher
Erkenntnisse zur Test-Effizienz der Mammographie als Screening-Methode.
Test-Effizienz der Mammographie als Früherkennungsuntersuchung
Von der Mammographie würde man sich wünschen, dass das Ergebnis immer eindeutig pathologisch ist, wenn tatsächlich auch Brustkrebs vorliegt und immer
eindeutig normal ist, wenn kein Brustkrebs vorliegt. Im Folgenden werden die Ergebnisse einer großen amerikanischen Untersuchung dargestellt, die feststellen
wollte, wie gut oder schlecht die Mammographie diese Anforderungen erfüllt.18,19 Diese Publikation wurde gewählt, weil sie die nötigen Rohdaten mitteilt,
die zu einer beispielhaften Darstellung erforderlich sind.
In der genannten Untersuchung nahmen 26.057 Frauen aus der Bevölkerung im Alter zwischen 30 bis über 70 Jahren an einem ersten Mammographie-Screening
teil. Danach wurden alle Fälle von histologisch gesichertem Brustkrebs erfasst, die bei diesen Frauen innerhalb der ersten 13 Monate nach der Mammographie
festgestellt wurden. Rückblickend wurde geprüft, ob das Ergebnis der Mammographie richtig war. Die Ergebnisse sind in Tabelle 4 zusammengefasst:

Erklärungen zu Tabelle 4:
- Insgesamt wurden 26.057 Frauen mammographiert.
- Bei 199 Frauen wurde histologisch Brustkrebs diagnostiziert. Der prozentuale Anteil der Frauen mit Brustkrebs an der Gesamtheit der Frauen, die mammographiert
wurden, betrug somit 0,8%. Das ist die Prävalenz von Brustkrebs in der untersuchten Frauengruppe. Sie entspricht der Vortest-Wahrscheinlichkeit für
Brustkrebs in dieser Gruppe von Frauen.
- Bei 1.850 Frauen war der Mammographiebefund positiv. Der prozentuale Anteil der Frauen mit positiver Mammographie an der Gesamtheit der Frauen, die
mammographiert wurden, betrug somit etwa 7%.
- Die Mammographie war bei 179 der 199 Frauen mit Brustkrebs positiv. Der prozentuale Anteil der Frauen mit Brustkrebs, bei denen die Mammographie
richtigerweise positiv war, betrug somit etwa 90%. Der prozentuale Anteil der Frauen mit Brustkrebs, bei denen die Mammographie positiv ausfällt, ergibt die
Sensitivität der Mammographie für die untersuchte Personengruppe.
- Insgesamt hatten 25.858 Frauen keinen Brustkrebs. Bei 24.187 dieser Frauen war die Mammographie richtig negativ. Bei den übrigen 1.671 Frauen ohne
Brustkrebs war sie jedoch falsch positiv. Der prozentuale Anteil der Frauen ohne Brustkrebs mit richtig negativer Mammographie war somit 93,5%. Der
prozentuale Anteil der Frauen ohne Brustkrebs, bei denen die Mammographie negativ ausfällt, ergibt die Spezifität der Mammographie für die untersuchte
Gruppe.
- Bei 20 von 199 Frauen mit Brustkrebs war die Mammographie normal. Das heißt, etwa 10% der Frauen mit Brustkrebs hatten einen falsch negativen
Mammographiebefund.
- Von 1.850 Frauen mit positiver Mammographie hatten 1.671 keinen Brustkrebs. Das heißt umgekehrt nur etwa 10% oder jede 10. Frau mit pathologischem
Mammographiebefund hatte tatsächlich Brustkrebs. Dies ist die Nach-Test-Wahrscheinlichkeit für das Vorhandensein von Brustkrebs oder der
positive prädiktive Wert der Mammographie für die untersuchte Personengruppe.
- Von 24.207 Frauen mit negativer Mammographie hatten 24.187 (99,9%) keinen Brustkrebs. Dies ist der negative prädiktive Wert der Mammographie
für die untersuchte Personengruppe.
Je häufiger Brustkrebs, umso besser die Test-Effizienz der Mammographie
Wieviel man mit Mammographie-Früherkennungsuntersuchungen erreichen kann, hängt davon ab, wie häufig Brustkrebs ist. Je höher die Prävalenz in einer
bestimmten Population, umso besser ist die Test-Effizienz der Mammographie.
Das nächste Beispiel illustriert diesen Zusammenhang. Es stützt sich wieder auf die bereits erwähnte amerikanische Untersuchung.18,19 Es werden die
Ergebnisse der Mammographie von Frauen im Alter von 30 bis 39 Jahren (Tabelle 5) mit jenen von Frauen im Alter von 60 bis 69 Jahren (Tabelle 6) verglichen.
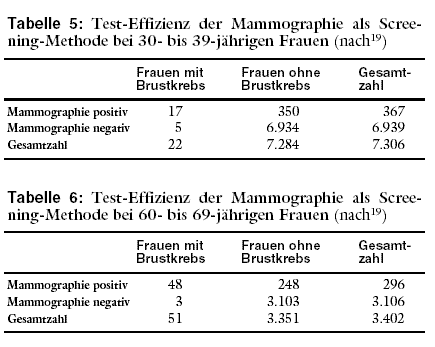
Insgesamt wurden 7.306 Frauen im Alter zwischen 30 und 39 Jahren mammographiert. Von diesen hatten 22 Brustkrebs. Die Prävalenz betrug somit 0,3%.
Anders dargestellt bedeutet dies, dass 3 von je 1.000 Frauen oder 1 von 333 Brustkrebs hatten.
In der Gruppe der 60- bis 69jährigen Frauen wurden insgesamt 3.402 Frauen mammographiert. Von diesen hatten 51 Brustkrebs. Das sind 1,5%. Anders dargestellt
bedeutet dies, dass 15 von 1.000 oder 1 von 67 Frauen Brustkrebs hatten.
Bei älteren Frauen deckte die Mammographie-Früherkennungsuntersuchung eher Brustkrebs auf als bei jüngeren Frauen. Fast jede 4. jüngere Frau, aber nur jede
17. ältere hatte in dieser Untersuchung einen falsch negativen Mammographiebefund. Anders dargestellt: Nur 77 von 100 jüngeren Frauen mit Brustkrebs hatten
auch einen pathologischen Mammographiebefund. Bei älteren Frauen waren dies hingegen 94 von 100.
Bei älteren Frauen war die Mammographie seltener falsch positiv als bei jüngeren Frauen. Bei jüngeren Frauen hatten 95 von 100 mit positivem
Mammographiebefund keinen Brustkrebs, nur jede 20. Frau mit positiver Mammographie hatte tatsächlich Brustkrebs. Bei älteren Frauen hatte hingegen jede 6. Frau
mit positiver Mammographie Brustkrebs, aber immer noch 84 von 100 Frauen mit positiver Mammographie hatten keinen Brustkrebs.
Bei älteren Frauen erfüllt die Mammographie somit eher die Ansprüche an eine gute Untersuchungsmethode. Trotzdem vermochte die Mammographie selbst bei den
älteren Frauen die Wahrscheinlichkeit für das Vorliegen von Brustkrebs nur von 1,5% auf 16% zu erhöhen. Die (Vor-Test-)Wahrscheinlichkeit, dass eine Frau im Alter
zwischen 60 und 69 Jahren Brustkrebs hatte, war in der untersuchten Population 1,5%. Die (Nach-Test-)Wahrscheinlichkeit, dass eine Frau im Alter zwischen 60 und
69 Jahren mit positiver Mammographie Brustkrebs hatte, war 16%. Welche der 16 von jeweils 100 Frauen tatsächlich Brustkrebs haben, muss durch weitere
Untersuchungen geklärt werden.
Bei jüngeren Frauen ist die Leistungsfähigkeit der Mammographie noch geringer. Die Vor-Test-Wahrscheinichkeit von 0,3% konnte durch die Mammographie nur auf
eine Nach-Test-Wahrscheinlichkeit von etwa 5% erhöht werden.
Die schlechtere Test-Effizienz der Mammographie als Screening-Methode bei jüngeren Frauen hat zwei Gründe:
- Eine schlechtere Sensitivität. Bei jüngeren Frauen enthält die Brust noch mehr Drüsengewebe und weniger Fettgewebe. Bösartig verändertes Gewebe
kann durch die Mammographie von Drüsengewebe nicht so gut unterschieden werden. Bei jüngeren Frauen tritt häufiger als bei älteren Frauen besonders bösartiger
Krebs auf, der sehr rasch wächst und deshalb selbst bei kurzen Untersuchungszeiträumen nicht immer festgestellt werden kann.
- Die bereits erwähnte geringere Prävalenz von Brustkrebs bei jüngeren Frauen. Selbst bei optimaler Untersuchungsmethode würde die Wahrscheinlichkeit,
dass Brustkrebs vorliegt, nur wenig durch eine Früherkennungsuntersuchung erhöht werden. Selbst bei Annahme einer Sensitivität von 95% und einer Spezifität von
98% bei gleichbleibender Prävalenz von Brustkrebs könnte die Vor-Test-Wahrscheinlichkeit von 0,3% durch das Mammographie-Screening nur auf eine Nach-
Test-Wahrscheinlichkeit von 13% erhöht werden.
Abhängigkeit der Test-Effizienz von der Definition eines positiven Befundes
In der vorgestellten amerikanischen Untersuchung18,19 wurden die Mammographiebilder als normal (Befund negativ) oder nicht normal (Befund positiv)
befundet. Bei positiven Befunden gab es drei Kategorien: 1.: weitere Abklärung notwendig; 2.: verdächtig auf Malignität, Biopsie empfohlen; 3.: maligne nach
radiologischen Kriterien.
Je wahrscheinlicher Brustkrebs auf Grund radiologischer Kriterien, umso größer war der positive prädiktive Wert (PPW). Für Befunde, für die eine weitere Abklärung
als notwendig erachtet wurde, betrug der PPW etwa 7%, für Befunde, die verdächtig auf Malignität waren, betrug der PPW etwa 55% und für Befunde, die als
maligne eingestuft wurden, lag der PPW bei fast 100%.
Nach einer Metaanalyse von Studien über systematisch durchgeführte Mammographie-Screening-Programme liegt die Sensitivität der Mammographie unter
Zugrundelegung eines Einjahres-Screeningintervalls und aller Altersgruppen zwischen 83% und 95% und die Spezifität zwischen 93% und 99%; für ein Zweijahres-
Screeningintervall sinkt die Sensitivität auf 71 %.28 Je höher die Sensitivität, umso niedriger die Spezifität und umgekehrt. Je höher der Anteil der Fälle an
Brustkrebs, die mit einem Mammographie-Screening-Programm diagnostiziert werden, umso höher auch der Anteil an falsch positiven Befunden und umso niedriger
der positive prädiktive Wert.3,28
Das holländische Nijmegen-Projekt ist ein Beispiel für ein Mammographie-Screening mit besonders hoher Spezifität.31,32 Bei Screening-Runden im Abstand von zwei
Jahren werden positive Mammographiebefunde (Definition: Überweisung zur weiteren Abklärung) bei nur etwa 1% der gescreenten Population erhoben, der positive
prädiktive Wert liegt bei etwa 60%, die Spezifität bei 99%.31 Die Sensitivität für das erste Jahr nach dem Screening wird für Frauen unter 50 Jahren mit 64%,
für ältere Frauen mit 80% bis 85% angegeben. Für die Zweijahres-Screeningintervalle beträgt die Sensitivität für Frauen unter 50 Jahren 44%, für ältere 62% bis
70%.32
In der Regelversorgung des amerikanischen Gesundheitssystems wurden von zertifizierten Radiologen bei Befundung identischer Mammographiebilder von Frauen
mit gesichertem Mammakarzinom Werte für die Sensitivität zwischen 47% und 100% gefunden. Für Frauen mit völlig normalem Brustgewebe lagen die Ergebnisse für
die Spezifität zwischen 37% und 100%.3 Radiologen mit hohen Trefferquoten für Karzinome hatten höhere Quoten an falsch positiven Befunden und
umgekehrt.
Tabelle 7: Welche Ergebnisse sind bei Mammographie-Früherkennungsuntersuchungen zu erwarten?
(nach19)
- Von 1.000 Frauen, die sich einer Mammographie-Früherkennungsuntersuchung unterziehen, haben 100 einen verdächtigen Befund.
- Von 1.000 Frauen, die sich einer Mammographie-Früherkennungsuntersuchung unterziehen, haben 900 einen normalen Befund.
- Von 1.000 Frauen mit verdächtigem Befund haben 100 Brustkrebs.
- Von 1.000 Frauen mit verdächtigem Befund haben 900 keinen Brustkrebs.
- Von 1.000 Frauen mit normalem Befund hat eine Frau Brustkrebs.
- Von 1.000 Frauen mit normalem Befund haben 999 keinen Brustkrebs.
Tabelle 7 zeigt ein Beispiel der Darstellung der Test-Effizienz der Mammographie als Screening-Methode für die Kommunikation mit den Frauen. Die zugrunde
liegenden Daten beziehen sich auf die erste Screening-Runde der vorgestellten amerikanischen Studie18,19 und nicht auf die holländischen Ergebnisse, da
für die strukturelle Situation in Deutschland eher die Beobachtungen aus den USA zutreffen dürften. Zur Vereinfachung der Darstellung wurden die Z ahlen
gerundet.
Unerwünschte Wirkungen von Mammographie-Screening -
Wer hat den Schaden?
Schaden durch Früherkennungsuntersuchung von Brustkrebs entsteht für folgende Frauen:
- Frauen, die niemals an Brustkrebs erkrankt wären, die sich jedoch wegen falsch positiver Mammographiebefunde weiteren diagnostischen Untersuchungen und
Eingriffen und im Extremfall einer Brust-Operation unterziehen.
- Frauen, bei denen Brustkrebs diagnostiziert oder behandelt wird, der sich ohne Früherkennungsuntersuchung zu Lebzeiten nicht bemerkbar gemacht hätte, da
sie zuvor an anderen Todesursachen verstorben wären.
- Frauen, bei denen Brustkrebs durch die Früherkennungsuntersuchung zwar früher diagnostiziert und behandelt wird, die Lebensqualität und Lebenserwartung
dadurch jedoch nicht verbessert werden - in diesem Fall führt die frühere Diagnose zu einer Verlängerung der Lebensspanne mit Brustkrebs, ohne die tatsächliche
Lebenserwartung zu verlängern.
- Frauen, bei denen Brustkrebs durch die Früherkennungsuntersuchung zwar früher diagnostiziert und behandelt wird, die Lebensqualität und Lebenserwartung
dadurch jedoch verschlechtert werden.
Die unerwünschten Wirkungen von Mammographie-Untersuchungen sind weniger gut dokumentiert als die gewünschten Wirkungen. Es gibt keine
systematischen Darstellungen der unerwünschten Wirkungen von Mammographie-Screening in Metaanalysen.
Folgen falsch positiver Befunde
Den folgenden Ausführungen liegen ausgewählte Untersuchungen aus den USA zu Grunde.9,17,19,21 Diese Arbeiten wurden gewählt, weil sie im
Gegensatz zu anderen Publikationen Angaben zu den entsprechenden Fragestellungen liefern. Zudem sind die strukturellen Bedingungen des Mammographie-
Screenings zwischen Deutschland und den USA vergleichbarer als zu anderen europäischen Ländern, in denen Mammographie-Screeningstudien durchgeführt
wurden. Die Publikation von ELMORE et al.9 zeigt Analysen für das Mammographie-Screening unter den Bedingungen der Regelversorgung.
Ergibt eine Mammographie-Untersuchung einen verdächtigen Befund, müssen weitere Untersuchungen durchgeführt werden, um die Diagnose Brustkrebs zu
sichern oder auszuschließen. Etwa 1 von 10 Frauen, die sich zum ersten Mal einer Mammographie-Früherkennungsuntersuchung unterzieht, hat einen falsch
positiven Befund. Bei weiteren Untersuchungen hat etwa 1 von 20 Frauen einen falsch positiven Befund.19
Von je 1.000 Frauen, die über einen Zeitraum von zehn Jahren je 5 Mammographie-Früherkennungsuntersuchungen durchführen lassen, haben etwa 250 Frauen -
oder 1 von 4 Frauen - mindestens einmal einen falsch positiven Befund.9
Fast alle Frauen mit falsch positivem Befund erhalten eine zusätzliche Mammographie oder eine Ultraschall-Untersuchung. Etwa 1 von 5 Frauen mit falsch positivem
Befund erhält eine Biopsie zur histologischen Abklärung des Mammographiebefundes.9
| Erläuterungen |
Likelihood Ratio
Das sog. Wahrscheinlichkeits-Verhältnis (Likelihood Ratio, LR) beschreibt, wie gut ein diagnostischer Test bei Personen mit einer bestimmten Erkrankung (z.B.
Brustkrebs) im Vergleich zu Personen ohne diese Erkrankung ist.34 Ein guter Test soll bei möglichst vielen Personen mit der Erkrankung positiv ausfallen und nur bei
möglichst wenigen, die diese Erkrankung nicht haben.
Das Verhältnis des Anteils der Personen mit der Erkrankung, bei denen das Testergebnis positiv ausfällt (Sensitivität) zum Anteil der Personen ohne die Erkrankung,
bei de-nen das Testergebnis positiv ausfällt, nennt man die positive Likelihood Ratio [PLR = Sensitivität : (1-Spezifität)]. Sie soll möglichst hoch
sein.
Andererseits soll ein guter Test bei möglichst wenigen Personen, die die Erkrankung haben, negativ sein, jedoch bei möglichst vielen, die die Erkrankung nicht
haben. Das Verhältnis des Anteils der Personen, die die Erkrankung haben und bei denen das Testergebnis negativ ausfällt, zum Anteil der Personen ohne die
Erkrankung, bei denen das Testergebnis negativ ausfällt, nennt man die negative Likelihood Ratio [NLR = (1-Sensitivität) : Spezifität]. Sie soll
möglichst niedrig sein. Die folgende Tabelle zeigt eine arbiträre Einteilung zur Beurteilung der Effizienz eines Tests nach PLR und NLR: |
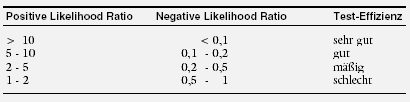 |
Prävalenz und prädiktive Werte
Selbst bei sehr guten Testeigenschaften (hohe positive Likelihood Ratio, PLR) ist bei niedriger Prävalenz einer Erkrankung der positive prädiktive Wert eines
diagnostischen Tests gering. Die folgende Tabelle zeigt diesen Zusammenhang anhand eines Beispiels eines guten Tests mit hoher PLR von 19 im Vergleich zu
einem weniger guten Test mit einer PLR von 2,3. |
 |
Positiver prädiktiver Wert (PPW) = positiver Vorher-sagewert = Wahrscheinlichkeit, mit der bei einem positiven Testergebnis die
Erkrankung tatsächlich vorliegt.
Negativer prädiktiver Wert = negativer Vorhersagewert = Wahrscheinlichkeit, mit der bei einem negativen Testergebnis die Erkrankung tatsächlich
nicht vorliegt.
Den Zusammenhang zwischen Mammographiebefund, positiver Likelihood Ratio und positiv prädiktivem Wert zeigt die folgende Tabelle. Die Daten beziehen sich
auf die Ergebnisse der amerikanischen Studie von KERLIKOWSKE et al.19 Es wird eine Prävalenz (Vor-Test-Wahrscheinlichkeit) von 1 %
angenommen. |
 |
Unerwünschte Brustkrebs-Diagnosen durch Früherkennungsuntersuchungen
Bei mehr Frauen, denen Mammographie-Früherkennungsuntersuchungen angeboten werden, wird die Diagnose Brustkrebs gestellt. Pro 4 Frauen ohne
Mammographie-Früherkennungsuntersuchungen kommt etwa eine zusätzliche Diagnose von Brustkrebs für Frauen mit Mammographie-
Früherkennungsuntersuchungen.2 Ein Beispiel:
Wenn ohne Mammographie in einem Zeitraum von zehn Jahren bei 20 von 1.000 Frauen Brustkrebs diagnostiziert wird, dann wird mit Mammographie innerhalb von
zehn Jahren bei etwa 25 von 1.000 Frauen Brustkrebs diagnostiziert.
Etwa doppelt so viele Frauen mit Mammographie-Früherkennungsuntersuchungen haben eine Diagnose von Brustkrebs in frühen Stadien im Vergleich zu den
Frauen ohne Mammographie-Früherkennungsuntersuchungen. Brustkrebs in fortgeschrittenen Stadien wird bei fast gleich vielen Frauen diagnostiziert, egal ob
Mammographie-Früherkennungsuntersuchungen angeboten werden oder nicht.2 Mehr Frauen, denen Mammographie-Früherkennungsuntersuchungen
angeboten werden, haben chirurgische und andere Behandlungen wegen Brustkrebs.2
Das intraduktale Karzinom in situ (DCIS) wird fast immer durch Mammographie-Früherkennungsuntersuchungen
entdeckt
Die meisten Fälle von Brustkrebs, die durch Mammographie-Screening im Frühstadium diagnostiziert werden, sind sog. intraduktale Carcinoma in situ (duktales
Carcinoma in situ = DCIS). Wieviele dieser intraduktalen Karzinome tatsächlich zu invasivem Brustkrebs werden und bei welchen Frauen, ist nicht genau bekannt.
Man schätzt, dass etwa die Hälfte der DCIS, jedoch oft erst nach 10 bis 20 Jahren zu invasivem Brustkrebs werden. Die meisten Frauen, bei denen ein DCIS
diagnostiziert wird, werden operativ behandelt, entweder durch Entfernen der Brust (Mastektomie) oder Entfernen des Tumors (Lumpektomie) mit oder ohne
zusätzliche Bestrahlung.39
Wie häufig wird DCIS diagnostiziert?
Beispiel für Frauen unter 50 Jahren:
- Von 1.000 Frauen, die sich zehn Jahre lang regelmäßig mammographieren lassen, wird für 10 invasive Karzinome bei 5 Frauen ein DCIS diagnostiziert.
- Von 1.000 Frauen, die sich über die nächsten zehn Jahre nicht mammographieren lassen, wird für 10 invasive Karzinome bei 1 Frau ein DCIS
diagnostiziert.
Beispiel für Frauen von 50 bis 60 Jahre:
- Von 1.000 Frauen, die sich zehn Jahre lang regelmäßig mammographieren lassen, wird für 25 invasive Karzinome bei 5 Frauen ein DCIS diagnostiziert.
- Von 1.000 Frauen, die sich über die nächsten zehn Jahre nicht mammographieren lassen, wird für 25 invasive Karzinome bei 1 Frau ein DCIS diagnostiziert.
Psychologische Auswirkungen von Mammographie-Früherkennungsuntersuchungen
Die psychologischen und sozialen Wirkungen von Mammographie-Früherkennungsuntersuchungen sind unzureichend untersucht. Ist man ängstlich und
beunruhigt, kann sich ein normales Mammographie-Ergebnis positiv auswirken. Ist das Mammographie-Ergebnis nicht normal, führt dies zur Beunruhigung. Manchmal
dauert es Wochen bis Monate, bis der verdächtige Befund abgeklärt ist.22
Wie hoch ist die Strahlenbelastung durch Mammographie?
Es wird geschätzt, dass pro 10.000 Frauen, die über einen Zeitraum von zehn Jahren jedes Jahr eine Mammographie haben, ein zusätzlicher Tod durch Brustkrebs
durch die Strahlenbelastung auftritt.25
Die Strahlenbelastung pro Mammographie (2 Aufnahmen pro Brust, insgesamt 4 Aufnahmen) soll 5 mSv nicht überschreiten.16 Die Strahlenbelastung bei der
Mammographie hängt von verschiedenen Faktoren ab. Vom Filmmaterial, von der technischen Anlage, von der Filmschwärzung und von der Dichte der
untersuchten Brust. Bei korrekter Durchführung kann die Dosis auf unter 2 mSv pro Mammographie-Untersuchung gehalten werden.
Das Risiko, durch Strahlenbelastung an Brustkrebs zu erkranken, kann nur geschätzt werden. Die Schätzungen beruhen auf Beobachtungsstudien an Frauen, die
hohen Strahlendosen ausgesetzt waren, zum Beispiel von Tuberkulosekranken Frauen mit häufigen Röntgen-Durchleuchtungen der Lungen oder Überlebenden der
Atombombenexplosionen in Hiroshima und Nagasaki.25
Die Gesamtstrahlenbelastung für 30 Mammographien vom 40. bis zum 70. Lebensjahr beträgt zwischen 60 mSv und 150 mSv bei Annahme einer Strahlenbelastung
zwischen 2 mSv und 5 mSv pro Mammographie-Untersuchung.
Nach Schätzungen liegt das zusätzliche Risiko für Brustkrebs durch diese Strahlenbelastung zwischen etwa 0,015% und 0,045%.16 Das würde bedeuten,
dass bei regelmäßiger Mammographie ab dem 40. Lebensjahr pro 10.000 Frauen mit 1,5 bis 4,5 zusätzlichen Brustkrebserkrankungen und 1 bis 2 zusätzlichen
Todesfällen durch Brustkrebs gerechnet werden müsste.
Das Brustgewebe junger Frauen ist strahlenempfindlicher als das älterer Frauen. Das Risiko für strahleninduzierten Brustkrebs ist bei Strahlenbelastung im Alter
zwischen 20 und 29 Jahren etwa doppelt so hoch wie im Alter zwischen 40 und 49 Jahren und etwa zehnmal so hoch wie für Frauen nach dem 50. Lebensjahr.
Frauen unter 20 Jahren sind besonders strahlenempfindlich. Es wird angenommen, dass strahlen induzierter Brustkrebs erst 10 bis 20 Jahre oder noch später nach
der Strahlenbelastung auftritt.16
Tabelle 8 zeigt eine Zusammenstellung einiger unerwünschter Wirkungen von Mammographie-Früherkennungsuntersuchungen auf Grund der genannten
wissenschaftlichen Studien zur Kommunikation mit den Frauen. Tabelle 9 gibt hypothetische Beispiele für Ergebnisse von Frauen im Alter zwischen 40 und 50 Jahren
und Tabelle 10 für Frauen im Alter zwischen 50 und 70 Jahren.


Annahmen: Gesamtsterblichkeit 2%, egal ob Mammographie-Früherkennungsuntersuchungen angeboten werden oder nicht.
25% Verminderung der Brustkrebs-Sterblichkeit durch Mammographie-Früherkennungsuntersuchungen. Zunahme der Brustkrebsdiagnosen durch Mammographie-
Früherkennungsuntersuchungen um 25%. Anteil der Frauen mit mindestens einem falsch positiven Mammographiebefund nach 10 Mammographien 50%. Anteil der
Frauen mit Biopsien nach zehn Jahren 20%.

Annahmen: Gesamtsterblichkeit 8%, egal ob Mammographie-Früherkennungsuntersuchungen angeboten werden oder nicht.
30% Verminderung der Brustkrebs-Sterblichkeit durch Mammographie-Früherkennungsuntersuchungen. Zunahme der Brustkrebsdiagnosen durch Mammographie-
Früherkennungsuntersuchungen um 20%. Anteil der Frauen mit mindestens einem falsch positiven Mammographiebefund nach 5 Mammographien 20%. Anteil der
Frauen mit Biopsien nach zehn Jahren 6%.
Unsicherheit der benutzten Daten
Trotz Bezug auf valide wissenschaftliche Untersuchungen sind die benutzten Daten mit Unsicherheiten verbunden. Die Übertragbarkeit auf bestimmte
Personengruppen unter bestimmten Bedingungen eines Gesundheitssystems sind limitiert. So hängt die Test-Effizienz der Mammographie nicht nur vom Alter der
untersuchten Frauen und der Prävalenz des Brustkrebses in einer bestimmten Population ab. Auch andere Faktoren spielen eine Rolle, z.B. wie gut die
Mammographie-Untersuchungen durchgeführt werden, wie gut die Mammographiebilder befundet werden und welche diagnostischen Kriterien Anwendung
finden.
Die Effizienz des Mammographie-Screenings auf die Brustkrebsmortalität hängt auch davon ab, wie hoch die Akzeptanz des Screenings in der Bevölkerung ist,
welche diagnostischen Maßnahmen bei verdächtigen Befunden erfolgen oder wie wirksam die Behandlungen sind, die bei diagnostiziertem Brustkrebs durchgeführt
werden. Je niedriger die Compliance der Frauen zum Screening-Angebot, umso schlechter die Gesamtergebnisse.
Da es in Deutschland bisher kein qualitätsgesichertes populationsbezogenes Screening-Programm zur Mammographie gibt, ist davon auszugehen, dass die Vorteil-
Nachteil-Relation des Brustkrebs-Screenings in Deutschland deutlich schlechter ist als in den klinischen Studien, in denen Compliance-Raten um 80% erreicht
wurden.
Jede Institution, die Mammographie-Screening anbietet, müsste auf Grund prospektiver vollständiger Nachuntersuchungen über mindestens ein Jahr von konsekutiv
gescreenten Frauen folgende Fragen beantworten können:
- Wie hoch ist die Treferquote für Brustkrebs (Sensitivität)?
Eine gute Trefferquote wäre mindestens 90 von 100. Das heißt, für mindestens 90 von 100 Frauen mit einer Brustkrebs-Diagnose im Untersuchungszeitraum von
einem Jahr sollte infolge des Mammographie-Screenings die Empfehlung zur histologischen Abklärung ausgesprochen worden sein.
- Wie hoch ist die Treferquote für gesunde Frauen (Spezifität)?
Eine gute Trefferquote wäre mindestens 95 von 100. Das heißt, bei mindestens 95 von 100 Frauen, bei denen kein Brustkrebs vorliegt, sollte auf Grund des
Mammographie-Screenings keine weitere außerplanmäßige Untersuchung gefordert worden sein.
Die Selbstuntersuchung und die ärztliche Untersuchung der Brust durch Palpation
Bisher konnte nicht gezeigt werden, dass die Brustkrebs-Sterblichkeit durch die regelmäßige Selbstuntersuchung der Brust vermindert werden kann.45 Beim
Abtasten der Brust werden mehr Fälle an Brustkrebs übersehen als durch Mammographie-Untersuchungen (falsch negative Befunde).
Auch die ärztliche Untersuchung der Brust durch Palpation ergibt schlechtere Ergebnisse als die Mammographie. Eine Untersuchung zu den Auswirkungen der
ärztlichen Brust-Untersuchung kam zu folgenden Ergebnissen:9
Werden bei 1.000 Frauen über einen Zeitraum von zehn Jahren jährliche Brust-Untersuchungen durch einen Arzt durchgeführt, so haben etwa 200 dieser Frauen
mindestens einmal ein falsch positives Ergebnis. Bei etwa 60 der 1.000 Frauen wird auf Grund dieser falsch positiven Befunde eine Biopsie durchgeführt.
Trugschlüsse,
warum Früherkennungsuntersuchungen von Brustkrebs
wirksam erscheinen können, obwohl sie es nicht sein müssen
Früherkennung von Brustkrebs hat einen Vorteil, wenn die Behandlung in einem früheren Stadium Tod durch Brustkrebs verhindern kann. Man ist geneigt, dies
als logisch zwingend zu akzeptieren. Trotzdem muss dies nicht unbedingt so sein. Der Eindruck, dass Früherkennungsuntersuchungen von Brustkrebs die
Überlebenschancen erhöhen, könnte auch ein Trugschluss sein. Es gibt drei Faktoren, die fälschlicherweise den Eindruck vermitteln könnten, dass Früherkennung
von Brustkrebs die Prognose verbessert, selbst wenn die Therapien unwirksam wären.
- Der Efekt der Freiwilligkeit: Personen, die an Früherkennungsuntersuchungen teilnehmen, sind gesünder und gesundheitsbewusster. Sie kommen eher
aus höheren sozialen Schichten und haben alleine dadurch schon eine bessere Lebenserwartung.
- Vorverlegung des Diagnosezeitpunkts: Angenommen, eine frühere Diagnose würde weder zu einer Verbesserung noch zu einer Verschlechterung der
Überlebenschance führen. Trotzdem hätte man in einem solchen Fall durch die frühere Diagnose den Eindruck einer verbesserten Prognose, da sich die Zeit
zwischen Diagnose und Tod verlängert. Erreicht hätte man jedoch lediglich eine Verlängerung der Zeitspanne, mit der man mit der Diagnose Brustkrebs lebt.
- Langsam wachsende Tumore werden eher diagnostiziert: Langsam wachsende Tumore haben eine bessere Prognose als rasch wachsende Tumore. Sie
bleiben somit länger in einem Stadium, in dem sie nur durch eine Früherkennungsuntersuchung erkannt werden können. Sie haben daher bei
Früherkennungsuntersuchungen eher die Chance diagnostiziert zu werden als die bösartigeren rascher wachsenden Tumore. Dadurch entsteht der Eindruck, dass
Früherkennungsuntersuchungen die Überlebenschance von Brustkrebs verbessern. Dies kann ein Trugschluss sein, da ja vorzugsweise jene Tumore entdeckt
werden, die auch ohne Früherkennungsuntersuchung eine bessere Prognose gehabt hätten.
Aus diesen Gründen kann die Wirksamkeit von Früherkennungsuntersuchungen nur durch randomisierte kontrollierte Studien (RCT's) belegt werden. Für das
Screening auf Brustkrebs und Darmkrebs liegen solche Studien vor, nicht jedoch für Zervix- oder Prostatakrebs.
| Anhang |
| Wie viele Frauen erkranken an Brustkrebs?
Häufig hört oder liest man, dass etwa 1 von 10 Frauen im Laufe ihres Lebens an Brustkrebs erkrankt. Wie kommt diese Zahl zustande? Nach dem Hamburger
Krebs-Register ergibt sich für das Jahr 1995 Folgendes:

Nur für jene Frauen, die das 80. Lebensjahr erreichen, gilt, dass 1 von 11 an Brustkrebs erkrankt. Für Frauen, die gerade das 50. Lebensjahr erreichen, gilt, dass
bei 1 von 61 Brust-krebs diagnostiziert wurde.
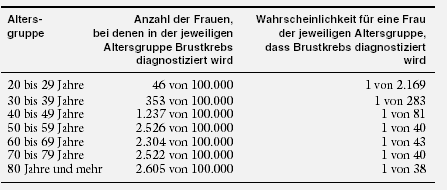
Für Frauen, die gerade das 50. Lebensjahr erreicht haben, gilt, dass bei 1 von je 40 in den nächsten zehn Jahren Brust-krebs diagnostiziert werden wird.
Wie viele Frauen sterben an Brustkrebs?
Die folgenden Tabellen nach dem Hamburger Krebs-Register* zeigen, wie viele Frauen im Jahr 1996 an Brustkrebs gestorben sind.

Bis zum 60. Lebensjahr sind 1.269 von je 100.000 Frauen an Brustkrebs verstorben oder 1 von jeweils 79 Frauen. Von Frauen, die das 80. Lebensjahr erreichen,
stirbt 1 von jeweils 30 an Brustkrebs.

Von 100.000 Frauen, die gerade 50 Jahre alt sind, sterben in den darauf folgenden zehn Jahren 822 an Brustkrebs oder 1 von je 122.
* Krebs-Register Hamburg für 1995 bzw. 1996. Ähnliche Zahlen werden aus dem Krebsregister Saarland oder aus
England/Wales berichtet.6
|
|