ZWEITER SGLT-2-HEMMER CANAGLIFLOZIN(INVOKANA) BEI TYP-2-DIABETES
Mit Canagliflozin (INVOKANA) ist seit März 2014 der zweite Hemmstoff des renalen Natrium-Glukose-Cotransporters 2 (SGLT 2) auf dem Markt. Wie der erste SGLT-2-Hemmer Dapagliflozin (FORXIGA; a-t 2013; 44: 1-3), dessen Vertrieb die Anbieter im Dezember 2013 eingestellt hatten (vgl. a-t 2014; 45: 14), ist Canagliflozin bei Erwachsenen mit Typ-2-Diabetes zur Monotherapie bei Unverträglichkeit von Metformin (GLUCOPHAGE, Generika) sowie als Zusatz zu anderen Antidiabetika einschließlich Insulin zugelassen.1 Dapagliflozin ist seit Anfang Mai mit deutlichem Preisnachlass wieder verfügbar, nachdem sich Hersteller und GKV-Spitzenverband nun doch auf einen Erstattungsbetrag geeinigt haben.
EIGENSCHAFTEN: Canagliflozin hemmt reversibel den Natrium-Glukose-Cotransporter 2 (SGLT 2), der im proximalen Tubulus der Niere den größten Teil der gefilterten Glukose aus dem Urin rückresorbiert.2 Mit dem vermehrt ausgeschiedenen Zucker gehen Kalorienverlust und osmotische Diurese einher.1,2 Die Wirksamkeit ist insulinunabhängig, wird aber von der Höhe des Blutzuckers und der Nierenfunktion bestimmt: Ab einer Kreatinin-Clearance von unter 45 ml/min werden keine klinisch relevanten Effekte mehr beobachtet.1-3

KLINISCHE WIRKSAMKEIT: Neun doppelblinde hauptsächlich plazebokontrollierte Phase-III-Studien bei Typ-2-Diabetes mit insgesamt rund 10.200 Probanden liegen der Zulassung zu Grunde, darunter zwei Subuntersuchungen aus der nicht abgeschlossenen CANVAS-Studie zur kardiovaskulären Sicherheit von Canagliflozin.1,2 Sieben Studien sind vollständig veröffentlicht.4-10 Die Patienten sind im Mittel 60 Jahre alt.1 Patienten mit schwerer, oft auch mit mäßiger Nierenininsuffizienz sind ausgeschlossen, ebenso Patienten mit Herzinsuffizienz NYHA (III-) IV.3 In einer der Studien wird Canagliflozin gezielt bei mäßiger Niereninsuffizienz (eGFR ≥ 30 bis < 50 ml/min) geprüft, in einer weiteren bei älteren Patienten (55 bis 80 Jahre).4,5 Es wird als Monotherapie oder als Zusatz zu einem oder zwei weiteren Antidiabetika untersucht. Primärer Endpunkt ist jeweils das HbA1c nach 18 bis 52 Wochen.2 In allen Studien wirkt der SGLT-2-Hemmer signifikant besser als Plazebo: Das HbA1c sinkt dosisabhängig im Mittel um 0,3% bis 0,9% (100 mg) bzw. um 0,4% bis 1,2% (300 mg) stärker als unter dem Scheinmedikament.2 Bei mäßiger Niereninsuffizienz ist der Effekt mit 0,3% bis 0,4% sehr gering,4 ebenso bei Patienten ab 75 Jahren (jeweils 0,5%).3 In Verumvergleichen erweist sich Canagliflozin nach 52 Wochen als mindestens so wirksam wie der Sulfonylharnstoff Glimepirid (AMARYL, Generika) und der DPP-4-Hemmstoff Sitagliptin (JANUVIA u.a.).6-8 Canagliflozin senkt das Körpergewicht gegenüber Plazebo in 18 bis 26 Wochen durchschnittlich um 1,8 kg (100 mg) bzw. 2,4 kg (300 mg).2 Ein klinischer Nutzen hinsichtlich Folgeerkrankungen des Diabetes ist nicht belegt.
UNERWÜNSCHTE WIRKUNGEN: Die unerwünschten Effekte von Canagliflozin entsprechen weitgehend denen von Dapagliflozin. In der Monotherapie nimmt das Hypoglykämierisiko geringfügig zu. In Kombination mit Sulfonylharnstoffen oder Insulin wird die Unterzuckerungshäufigkeit aber deutlich gesteigert.2,3 Im direkten Vergleich ist das Hypoglykämierisiko höher oder ähnlich wie unter Sitagliptin,6,8 aber geringer als unter Glimepirid.7 Hierzu könnte allerdings beigetragen haben, dass Glimepirid, nicht aber Canagliflozin, ähnlich wie die Sulfonylharnstoffe in Zulassungsstudien von Gliptinen (vgl. a-t 2013; 44: 73-5) forciert auf eine normnahe Blutzuckereinstellung hin titriert wird, die nach heutigen Empfehlungen gar nicht mehr allgemein angestrebt wird.11
Verstärktes Wasserlassen mit Polyurie, Harndrang oder Nykturie ist wie zu erwarten häufig (5,3% [100 mg] bzw. 4,6% [300 mg] vs. 0,8% unter Plazebo). Auch die häufigen
genitalen Pilzinfektionen bei Frauen (10% bzw. 11% vs. 3%) und Männern (jeweils 4% vs. 0,6%) und die erhöhte Rate an Harnwegsinfektionen (5,9% bzw. 4,3% vs. 4%)12 werden mit der durch Canagliflozin induzierten Glukosurie in Verbindung gebracht.2,13 Die osmotische Diurese kann zu Volumenmangel einschließlich Blutdruckabfall führen (2,3% bzw. 3,4% vs. 1,5% in Kontrollgruppen), durch die besonders ältere Patienten (≥ 75 Jahre: 4,9% bzw. 8,7% vs. 2,6%) und Patienten mit eingeschränkter Nierenfunktion (4,7% bzw. 8,1% vs. 2,5%) gefährdet sind.12 Bei - auch interkurrentem - Volumenmangel wird Canagliflozin nicht empfohlen.1 Nierenfunktionsstörungen bis hin zum akuten Nierenversagen betreffen ebenfalls vorwiegend Patienten mit vorbestehender Niereninsuffizienz (8,9% bzw. 9,3% vs. 3,7% unter Plazebo).12
Canagliflozin geht mit erhöhter Rate von Überempfindlichkeitsreaktionen wie Urtikaria oder Angioödem (3,8% bzw. 4,2% vs. 3,0%) einher.12 Die gering erhöhte Frakturrate (1,9% bzw. 1,8% vs. 1,4%) insbesondere der oberen Extremitäten könnte durch eine Zunahme von Stürzen infolge Blutdruckabfall unter Canagliflozin bedingt sein.2 Ob auch die beobachtete mäßige Zunahme der Knochenresorptionsparameter zum Auftreten von Frakturen beitragen kann, müssen Langzeitbeobachtungen klären.14
Während ein kardiovaskulärer Nutzen von Canagliflozin nicht belegt ist, ergeben sich aus den Daten Risikosignale: In den ersten 30 Behandlungstagen kommt es in der CANVAS-Studie unter beiden Dosierungen zu einem numerischen Anstieg kardiovaskulärer Komplikationen (sieben bzw. sechs Patienten vs. einer unter Plazebo). Als mögliche Ursache wird die akute Gefährdung von Hochrisikopatienten, wie sie an CANVAS teilnehmen, durch den Canagliflozin-induzierten Volumenmangel und Blutdruckabfall diskutiert. In einer Postmarketingstudie soll dieses potenzielle akute Risiko auf Empfehlung der FDA überprüft werden.13 In einer Metaanalyse zu kardiovaskulären Ereignissen in Phase-II- und -III-Studien findet sich zudem ein numerischer Anstieg von Schlaganfällen unter Canagliflozin (Hazard Ratio [HR] 1,47; 95% CI 0,83-2,59).2,13
Wie unter anderen, experimentellen SGLT-2-Hemmern werden im Tierversuch unter Canagliflozin gehäuft Phäochromozytome, Leydig-Zell-Tumoren und tubuläre Nierentumoren beobachtet.3 In klinischen Studien mit Canagliflozin sind diese Tumoren nicht bzw. nicht vermehrt aufgetreten. Auch eine Zunahme von Blasen- oder Brustkrebs wie unter Dapagliflozin findet sich in klinischen Studien mit Canagliflozin nicht.2 Der FDA sind seit Zulassung von Canagliflozin jedoch mindestens fünf Blasenkrebserkrankungen unter dem Mittel bekannt geworden.15
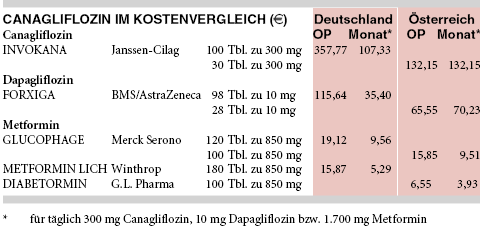
KOSTEN: Canagliflozin (INVOKANA) verteuert die Therapie des Typ-2-Diabetes mit monatlich 107 € für täglich 300 mg gegenüber einem preisgünstigen Metformingenerikum (METFORMIN LICH; monatlich 5 € für täglich 1.700 mg) auf mehr als das Zwanzigfache. Dagegen haben sich die Kosten für den ersten SGLT-2-Hemmer Dapagliflozin (FORXIGA; monatlich 35 € für täglich 10 mg) als Folge der Preisverhandlungen mit dem GKV-Spitzenverband gegenüber dem Preisstand bei Markteinführung (monatlich 69 € für täglich 10 mg) fast halbiert. Auch wenn dieser Preisnachlass groß erscheint, verstößt er nach wie vor gegen die Gesetzesvorgaben, wonach Arzneimittel wie Dapagliflozin, denen vom Gemeinsamen Bundesausschuss kein Zusatznutzen zuerkannt wurde, nicht teurer sein dürfen als die zweckmäßige Vergleichstherapie (vgl. a-t 2013; 44: 53-4).
Der zweite SGLT-2-Hemmer
Canagliflozin (INVOKANA) senkt in Kurzzeitstudien das HbA1c bei Typ-2-Diabetes im Vergleich zu Plazebo dosisabhängig um 0,3% bis 1,2%.
Das Störwirkungsspektrum entspricht mit verstärktem Wasserlassen, häufigen genitalen und Harnwegsinfektionen sowie Volumenmangel und Nierenfunktionsstörungen dem des ersten Vertreters der Wirkgruppe, Dapagliflozin (FORXIGA).
Während ein klinischer Nutzen nicht belegt ist, ergeben sich aus den Daten kardiovaskuläre Risikosignale, insbesondere der Hinweis auf eine akute Zunahme kardiovaskulärer Komplikationen zu Behandlungsbeginn.
Wir sehen beim derzeitigen Kenntnisstand weder für Canagliflozin noch für Dapagliflozin eine Indikation.
| (R = randomisierte Studie) | |
| 1 | Janssen: Fachinformation INVOKANA, Stand Nov. 2013 |
| 2 | EMA: Europ. Beurteilungsbericht (EPAR) INVOKANA, Stand Sept. 2013 http://www.a-turl.de/?k=ueid |
| 3 | FDA: Medical Review(s) INVOKANA, Stand Febr. 2013 http://www.a-turl.de/?k=tadl |
| R 4 | YALE, J.F. et al.: Diabetes Obes. Metab. 2013; 15: 463-73 |
| R 5 | BODE, B. et al.: Hosp. Pract. 2013; 41: 72-84 |
| R 6 | LAVALLE-GONZÁLES, F.B. et al.: Diabetologia 2013; 56: 2582-92 |
| R 7 | CAFALU, W.T. et al.: Lancet 2013; 382: 941-50 |
| R 8 | SCHERNTHANER, G. et al.: Diabetes Care 2013; 36: 2508-15 |
| R 9 | STENLÖF, K. et al.: Diabetes Obes. Metab. 2013; 15: 372-82 |
| R 10 | WILDING, J.P. et al.: Int. J. Clin. Pract. 2013; 67: 1267-82 |
| 11 | Nationale Versorgungsleitlinie: Therapie des Typ-2-Diabetes, Aug. 2013, Stand Apr. 2014; http://www.a-turl.de/?k=ento |
| 12 | JANSSEN: US-amerikanische Produktinformation INVOKANA, Stand März 2013; http://www.a-turl.de/?k=rosi |
| 13 | FDA: Summary Review INVOKANA, Stand März 2013 http://www.a-turl.de/?k=aife |
| 14 | FDA: Other Review INVOKANA, Stand März 2013 http://www.a-turl.de/?k=arge |
| 15 | FDA: Endocrinologic and Metabolic Drugs Advisory Committee Meeting:
Introductory Remarks, Stand Dez. 2013; http://www.a-turl.de/?k=erdi |
© 2014 arznei-telegramm, publiziert am 9. Mai 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
