DIABETESMITTEL DAPAGLIFLOZIN (FORXIGA)
Seit Dezember 2012 ist mit Dapagliflozin (FORXIGA) ein Mittel zur Behandlung des Typ-2-Diabetes mit neuem Wirkmechanismus im Handel: Dapagliflozin fördert die Glukoseausscheidung über die Nieren. Es wird zur Monotherapie bei Unverträglichkeit von Metformin (GLUCOPHAGE, Generika) sowie als Zusatz zu anderen Antidiabetika einschließlich Insulin angeboten.1 In den USA ist das Mittel bislang nicht auf dem Markt. Ein Beratergremium hat sich 2011 vor allem wegen Sicherheitsbedenken gegen die Zulassung ausgesprochen.2
EIGENSCHAFTEN: Dapagliflozin ist ein kompetitiver selektiver reversibler Hemmstoff des Natrium-Glukose-Cotransporters 2 (SGLT-2), dem Haupttransporter für die Reabsorption von Glukose aus dem glomerulären Filtrat in den Nieren. SGLT-2 soll praktisch ausschließlich in den Nieren vorkommen. Die Wirksamkeit von Dapagliflozin ist nicht von der Betazellfunktion oder der Insulinsensitivität abhängig, wohl aber von der Höhe des Blutzuckers und der glomerulären Filtrationsrate. Ab einer mäßigen Niereninsuffizienz (Kreatininclearance unter 60 ml/min) ist kein Effekt mehr belegt.3,4 Mit dem vermehrt ausgeschiedenen Zucker (pro Tag etwa 70 g) geht ein Verlust von Kalorien (etwa 280 kcal/Tag) und eine osmotische Diurese mit Erhöhung der Harnmenge (etwa 375 ml/Tag) einher. 1

WIRKSAMKEIT: Die Zulassung beruht auf elf doppelblinden Phase-III-Studien bei Typ-2-Diabetes mit insgesamt 5.693 im Mittel 56 Jahre alten Patienten. Primärer Endpunkt in neun plazebokontrollierten Studien ist das HbA1c nach 24 Wochen, in einer verumkontrollierten Studie nach 52 Wochen. In einer weiteren plazebokontrollierten Studie wird die Wirkung von Dapagliflozin auf das Körpergewicht in 24 Wochen geprüft. In zwei plazebokontrollierten Studien wird Dapagliflozin als Monotherapie verwendet, in sechs Studien als Zusatz zu Metformin, Sulfonylharnstoff, Glitazon oder Insulin, in dreien sowohl als auch. Patienten mit schwerer Niereninsuffizienz, signifikanter Lebererkrankung oder schwererer kardiovaskulärer Erkrankung einschließlich Herzinsuffizienz NYHA III und IV sind ausgeschlossen. Die Patienten mussten zudem Kalziumspiegel im Normbereich aufweisen.4
In den Hauptstudien senken täglich 10 mg Dapagliflozin den HbA1c-Wert im Vergleich zu Plazebo um 0,54% bis 0,68%. Im Verumvergleich ist die Neuerung (täglich bis zu 10 mg) dem Sulfonylharnstoff Glipizid (außer Handel: GLIBINESE) nicht unterlegen. Bei mäßiger Niereninsuffizienz hat Dapagliflozin in einer eigens mit dieser Patientengruppe durchgeführten Studie keinen signifikanten Effekt. Das Mittel senkt das Körpergewicht, in 24 Wochen durchschnittlich etwa um 1 kg bis 2 kg im Vergleich zu Plazebo, wobei ein Teil davon auf Flüssigkeitsverlust zurückzuführen sein dürfte.4 Ein klinischer Nutzen im Hinblick auf Folgeerkrankungen des Diabetes ist nicht belegt.
UNERWÜNSCHTE EFFEKTE: Bei Monotherapie scheint das Hypoglykämierisiko gering zu sein.4,5 Dapagliflozin steigert aber die Unterzuckerungshäufigkeit bei Komedikation mit Insulin und Sulfonylharnstoffen. Es geht häufig mit Polyurie, Dysurie, Harnwegs- (4,3% versus 3,7% unter Plazebo) oder Genital- (4,8% vs. 0,9%) Infektionen einher, was auf den Wirkmechanismus einer Glukosurie und verstärkten Diurese zurückzuführen sein dürfte. Es kann zudem Volumenmangel einschließlich Blutdruckabfall (0,8% vs. 0,4%)1 auslösen, besonders bei Komedikation mit Schleifendiuretika (9,7% vs. 1,8%).4 Auch über 65-Jährige (1,5% vs. 0,4%)1 und Patienten mit mäßiger Niereninsuffizienz sind stärker gefährdet.4 Bei Volumenmangel, auch im Rahmen interkurrenter Erkrankungen z.B. des Magen-Darm-Trakts, Niereninsuffizienz mit Kreatininclearance unter 60 ml/min oder Anwendung von Schleifendiuretika soll Dapagliflozin nicht verordnet werden.1 Prärenales Nierenversagen ist beschrieben.3 Die unter Dapagliflozin etwas häufiger beobachteten Nierenfunktionsstörungen (1,2% vs. 0,9%), vor allem Kreatininanstiege, werden zumindest zum Teil auf Dehydratation zurückgeführt.4 Auch hier sind die über 65-jährigen Patienten (2,5% vs. 1,1%)1 und die mit mäßiger Niereninsuffizienz häufiger betroffen.4 Die Nierenfunktion muss vor und regelmäßig während der Therapie überwacht werden. Entwickelt sich eine mäßige Niereninsuffizienz, soll das Mittel abgesetzt werden.1 Der Hämatokrit steigt unter Dapagliflozin im Mittel um 2,15%, während er unter Plazebo um 0,4% abnimmt. Anstiege auf über 55% finden sich bei 1,3% unter Dapagliflozin vs. 0,3% unter Scheinmedikament. Die kardiovaskuläre Sicherheit der Neuerung ist insbesondere bei vorbestehenden Herz-Kreislauf-Erkrankungen nicht belegt. In zwei während des Zulassungsprozesses eingereichten Phase-IIIb-Studien zu dieser Patientengruppe mit jeweils mehr als 900 Teilnehmern ergibt sich eine numerische Zunahme schwerer Ereignisse wie Herzinfarkt oder Schlaganfall gegenüber Plazebo (HR 1,27; 95% CI 0,693-2,311).4 Eine primär auf schwerwiegende kardiovaskuläre Ereignisse angelegte plazebokontrollierte Add-on-Studie mit geplanter Teilnehmerzahl von mehr als 17.000 Patienten soll im April 2013 beginnen.6
Aufgrund des Wirkmechanismus bestehen Bedenken, dass Dapagliflozin den Knochen schädigen kann. Kalziumwerte im Serum und Urin sollen sich im Mittel nicht relevant verändern, Phosphat und Parathormon im Serum im Mittel aber leicht ansteigen, ebenso Knochenresorptionsmarker im Serum und Urin. Bei gepoolter Analyse der Zulassungsstudien wird eine Zunahme von Knochenbrüchen unter Dapagliflozin nicht beobachtet. In der Studie bei Patienten mit mäßiger Niereninsuffizienz ist die Frakturrate unter der Neuerung jedoch erhöht (4,8% und 9,4% unter täglich 5 mg bzw. 10 mg vs. 0% unter Plazebo).4
Leberfunktionstests sind insgesamt unauffällig. Allerdings kommt es unter Dapagliflozin bei einem Patienten zu einem als möglich (EMA) bzw. wahrscheinlich (FDA) eingestuften Arzneimittel-induzierten Leberschaden mit deutlichem Anstieg sowohl von Transaminasen als auch von Bilirubin ohne alternative Erklärung.4,5 Nach Erfahrungen der FDA würden bereits zwei solche Leberschäden im Studienprogramm mit hoher Wahrscheinlichkeit ein lebertoxisches Potenzial eines Wirkstoffs vorhersagen.5
Besondere Bedenken bestehen auch wegen der im Studienprogramm beobachteten numerisch erhöhten Rate an Blasen- (etwa fünffach), Brust- und Prostatakarzinomen (jeweils etwa zweifach) unter Dapagliflozin. Potenzielle Wirkmechanismen sind unklar. Im Tierversuch mit Nagern ist kein karzinogenes Potenzial des Mittels erkennbar. Die Krebserkrankungen gehören aber ebenso wie schwere Harnwegsinfektionen, klinische Konsequenzen des Hämatokritanstiegs, kardiovaskuläre Ereignisse, akutes Nierenversagen, Knochenbrüche und Leberschäden zu den offenen Sicherheitsfragen, die unter anderem durch gezielte Überwachung nach Markteinführung weiter geklärt werden sollen.4 Wegen des potenziell erhöhten Blasenkrebsrisikos wird eine Komedikation mit dem hier ebenfalls riskanten Pioglitazon (ACTOS) nicht empfohlen.1
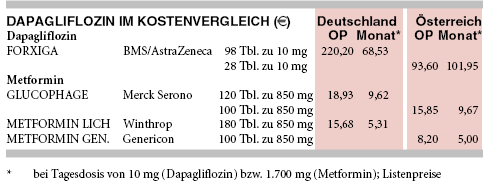
KOSTEN: Dapagliflozin (FORXIGA) kostet pro Monat 69 € für täglich 10 mg. Es verteuert die Therapie des Typ-2-Diabetes gegenüber einem günstigen Metformin-Generikum (z.B. METFORMIN LICH; monatlich 5 € für täglich 1.700 mg) auf das 13-Fache.
Das neue orale Antidiabetikum Dapagliflozin (FORXIGA), das die renale Glukosereabsorption hemmt und zur Behandlung des Typ-2-Diabetes angeboten wird, senkt den HbA1c-Wert mäßig um 0,5% bis 0,7%.
Schon bei mäßiger Niereninsuffizienz hat das Mittel keinen Effekt mehr, verursacht aber mehr relevante Störwirkungen und wird hier nicht empfohlen. Die Kreatininclearance muss regelmäßig überwacht werden.
Bei Komedikation mit Insulin oder Sulfonylharnstoffen steigt das Hypoglykämierisiko.
Wahrscheinlich als Folge der durch Dapagliflozin induzierten Glukosurie nehmen Polyurie, Dysurie, Harnwegs- und Genitalinfektionen sowie Volumenmangel mit Blutdruckabfall oder Dehydratation zu. Prärenales Nierenversagen ist beschrieben. Besonders gefährdet durch Volumenmangel sind ältere Patienten und Patienten, die Diuretika einnehmen.
Ein Nutzen im Hinblick auf Folgeerkrankungen des Diabetes ist nicht belegt. Bei vorbestehenden Herz-Kreislauferkrankungen sind schwerwiegende kardiovaskuläre Ereignisse unter Dapagliflozin numerisch häufiger.
Bedenken bestehen insbesondere auch wegen auffällig häufiger Knochenbrüche bei Patienten mit mäßiger Niereninsuffizienz, potenzieller Lebertoxizität sowie wegen einer numerisch höheren Rate von Blasen-, Brust- und Prostatakarzinomen unter Dapagliflozin in Zulassungsstudien.
Beim derzeitigen Kenntnisstand erachten wir die Nutzen-Schaden-Bilanz der Neuerung als negativ. Wir raten von dem teuren Mittel ab.
© 2013 arznei-telegramm, publiziert am 18. Januar 2013
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
