ORALER THROMBINHEMMER DABIGATRANETEXILAT (PRADAXA)
Seit April 2008 ist mit Dabigatranetexilat (PRADAXA) erneut ein oraler Thrombinhemmer zur Prophylaxe venöser Thromboembolien nach elektivem Hüft- oder Kniegelenksersatz auf dem Markt.1 Der erste Vertreter dieser Wirkstoffklasse - Ximelagatran (EXANTA; a-t 2004; 35: 69-70) - musste im Februar 2006, eineinhalb Jahre nach Markteinführung, wegen schwerer Leberschäden weltweit vom Markt genommen werden (blitz-a-t vom 14. Febr. 2006). In Großbritannien und den USA hatte das Mittel wegen Sicherheitsbedenken nie eine Zulassung erhalten. Das den Gerinnungsfaktor IIa (Thrombin) hemmende Dabigatran wird voraussichtlich noch in diesem Jahr Konkurrenz durch den ersten oralen Faktor-Xa-Inhibitor Rivaroxaban bekommen, dessen Zulassung bei der europäischen Behörde (EMEA) im Oktober 2007 beantragt wurde. Andere Thrombin- und Faktor-Xa-Hemmer werden folgen.2,3
EIGENSCHAFTEN: Das inaktive Prodrug Dabigatranetexilat wird nach Absorption aus dem Darm in Plasma und Leber schnell durch Esterasen in das aktive Dabigatran umgewandelt. Es hemmt direkt (unabhängig von Antithrombin), reversibel und kompetitiv freies wie gebundenes Thrombin und dadurch auch die Thrombin-induzierte Thrombozytenaggregation. Die antikoagulatorische Wirkung ist direkt proportional zur Plasmakonzentration. Routinetests wie aPTT und INR sind im therapeutischen Bereich nicht sensitiv genug und eignen sich nicht für die Steuerung der Therapie.
Die Thrombinzeit und die Ecarinzeit* erfassen zwar ausreichend sensitiv den gerinnungshemmenden Effekt des Thrombinhemmers, sind aber für den Routinegebrauch unzureichend standardisiert. Ein Antidot gegen Dabigatran ist nicht bekannt.4,5

KLINISCHE WIRKSAMKEIT: Die europäische Behörde EMEA hat für die Zulassung zur perioperativen Thromboembolieprophylaxe bei großen orthopädischen Eingriffen an Hüfte und Knie vier multizentrische randomisierte Doppelblindstudien berücksichtigt.4 In diesen wird Dabigatran mit dem in dieser Indikation als Standard geltenden niedermolekularen Heparin Enoxaparin (CLEXANE) verglichen.10
Aus der Dosisfindungsstudie BISTRO** II,6 in der Tagesdosierungen von 2 x 50 mg, 2 x 150 mg, 1 x 300 mg und 2 x 225 mg Dabigatran über sechs bis zehn Tage mit 40 mg Enoxaparin verglichen werden, wird eine optimale Tagesdosis für Dabigatran zwischen 100 mg und 300 mg abgeleitet.
Drei dreiarmige Phase-III-Studien vergleichen jeweils einmal täglich 150 mg und 220 mg Dabigatran mit Enoxaparin bei insgesamt 6.185 Patienten. Initial wird postoperativ nur die halbe Dabigatrandosis (75 mg oder 110 mg) eingenommen, in den beiden europäischen Studien ein bis vier, in der nordamerikanischen sechs bis zwölf Stunden postoperativ. Solche Dosierungen sind in keiner Dosisfindungsstudie geprüft. Enoxaparin wird in den europäischen Studien in einer Dosis von täglich 40 mg beginnend am Abend vor der Operation, in der nordamerikanischen entsprechend dortiger Empfehlung in einer Tagesdosis von 2 x 30 mg beginnend 12 bis 24 Stunden nach der Operation verabreicht. Die Untersuchungen sind auf Nichtunterlegenheit angelegt. Primärer Endpunkt ist die Kombination aus venösen Thromboembolien und Gesamtmortalität. Als Thromboembolien sind phlebografisch festgestellte oder durch Phlebografie, Ultraschall oder Autopsie bestätigte distale oder proximale Venenthrombosen oder objektivierte Lungenembolien definiert. Für etwa 25% der Patienten sind keine auswertbaren Phlebografien verfügbar.4 Sie gehen nicht in die primäre Wirksamkeitsanalyse ein, soweit sie nicht ein klinisches Ereignis erleiden.
In den beiden europäischen Studien (RE-MODEL**7 und RE-NOVATE**8) gelingt jeweils der Nachweis einer Nichtunterlegenheit für den primären Endpunkt (siehe Tabelle). Eine signifikante Überlegenheit lässt sich für den Thrombinhemmer jedoch nicht belegen. Für proximale oder symptomatische Thrombosen finden sich keine Unterschiede zu Enoxaparin. Auch die insgesamt niedrige Mortalität ist in den Behandlungsgruppen etwa gleich (0% bis 0,3%). Die Raten schwerer und leichter Blutungen unter Dabigatran und Enoxaparin weisen keine signifikante Unterschiede auf.
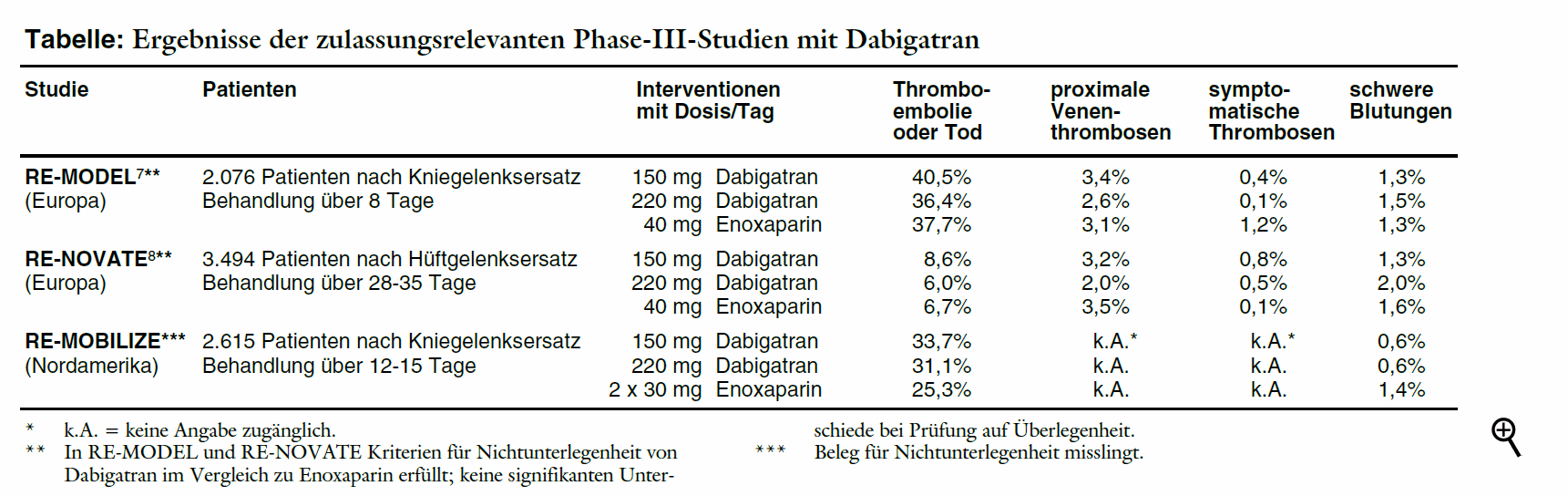
Die nordamerikanische RE-MOBILIZE**-Studie ist nach wie vor nicht veröffentlicht, obgleich der Hersteller über die Ergebnisse bereits im Juli 2007 informiert hat.9 Gegenüber 60 mg Enoxaparin misslingt hier der Nachweis einer Nichtunterlegenheit. Blutungen sollen gleich häufig sein.
Methodisch ist zu bemängeln, dass keine Gegenüberstellungen adäquater Per-Protokoll- und Intention-to-treat-Analysen vorgenommen werden, die bei Nichtunterlegenheitsstudien zumindest für Sensitivitätsanalysen gefordert werden.11 Problematisch ist auch die große Anzahl von Patienten mit nicht auswertbaren Phlebografien. Bei "worst-case"-Szenarien wäre eine Nichtunterlegenheit zumindest für die 150-mg-Dosis nicht mehr gewährleistet.12 Zudem wird ein primärer kombinierter Endpunkt gewählt, der wesentlich durch die hohe Inzidenz asymptomatischer und distaler Thrombosen bestimmt wird. Diese Ereignisse sind als Surrogatendpunkte anzusehen. Für Aussagen zu klinisch relevanten Endpunkten (symptomatische Venenthrombosen und Lungenembolien, Mortalität), wie sie von der EMEA gefordert werden,13 besitzen die Studien keine ausreichende Power.2 Eine Nichtunterlegenheit von Dabigatran hinsichtlich klinisch relevanter thromboembolischer Komplikationen kann deshalb auch im Vergleich zum europäischen Dosisregime von Enoxaparin nicht als ausreichend bewiesen angesehen werden.
VERTRÄGLICHKEIT: Am häufigsten werden in den relevanten Studien Übelkeit (20% bis 25%), Erbrechen (16% bis 17%), Verstopfung (11% bis 12%), Schlafstörungen (8%), periphere Ödeme (6% bis 7%) und sezernierende Wunden (5% bis 7%) angegeben.2 Unterschiede zu Enoxaparin sind nicht erkennbar. Die Blutungsraten sind dosisabhängig, bei Einnahme von 150 mg und 220 mg Dabigatran aber nicht häufiger als bei Injektion von 40 mg bzw. 2 x 30 mg Enoxaparin. Blutungen treten bei eingeschränkter Nierenfunktion, Alter über 75 Jahre und Untergewicht häufiger auf. Für solche Patienten sind Beobachtungsstudien nach der Marktzulassung zur Auflage gemacht worden.
Besonderes Augenmerk gilt der Leberverträglichkeit. Dabigatran besitzt große Strukturähnlichkeit mit dem leberschädigenden Ximelagatran. In den Studien sind erhöhte Transaminasen (über das Dreifache der Norm) unter Dabigatran zwar etwas seltener vorgekommen als unter Enoxaparin (3% bis 4% versus 4% bis 5%).7,8 Diese Arbeiten eignen sich aber nicht, das lebertoxische Potenzial von Dabigatran zu klären. Sie sind zu kurz und könnten durch Vergleich mit Enoxaparin - bei dem passagere benigne Transaminasenanstiege bekannt sind - eine möglicherweise nicht gegebene Sicherheit vortäuschen.10 Für längere Anwendungen, z.B. in anderen bisher nicht zugelassenen Indikationen wie Vorhofflimmern, liegen keine ausreichenden Daten vor.2
KOSTEN: Gegenüber Enoxaparin-Fertigspritzen (CLEXANE; 40 mg/Tag, 67 (/10 Tage nach elektivem Kniegelenksersatz) verteuert der orale Thrombinhemmer Dabigatranetexilat (PRADAXA; 220 mg/Tag, 71 €/10 Tage) die Thromboembolieprophylaxe nur gering um 5%, gegenüber Enoxaparin-Multidose (41 €/10 Tage) jedoch um 42%. Nicht akzeptabel ist, dass Boehringer Ingelheim keine für die Prophylaxe nach elektivem Kniegelenksersatz geeignete Packungsgröße mit 20 Tabletten zu 110 mg anbietet.

Mit Dabigatranetexilat (PRADAXA) steht erneut ein oraler Thrombinhemmer zur Prophylaxe venöser Thromboembolien nach elektivem Hüft- oder Kniegelenksersatz zur Verfügung.
Dabigatran vermindert Thromboembolien nicht schlechter als eine Standardprophylaxe mit Enoxaparin (CLEXANE).
In den Vergleichsstudien werden hauptsächlich distale und rein phlebografisch erkannte Thrombosen erfasst. Ob klinisch relevante symptomatische Thrombosen und Lungenembolien ähnlich oder zumindest nicht schlechter als durch Enoxaparin reduziert werden, ist unbewiesen.
Bisher liegen keine konkreten Hinweise auf Lebertoxizität vor. Die Strukturverwandtschaft mit dem wegen Leberschädlichkeit aus dem Handel gezogenen Ximelagatran (EXANTA) und fehlende Langzeitdaten mahnen aber zur Vorsicht.
Für eine vergleichende Nutzen-Schaden-Bewertung z.B. mit Enoxaparin fehlen somit entscheidende Daten.
Der Vorteil der Einnahme wiegt unseres Erachtens bei zeitlich begrenzter Anwendung wie der Thromboembolieprophylaxe nach orthopädischen Eingriffen die Unsicherheiten hinsichtlich Nutzen und Sicherheit nicht auf.
| (R = randomisierte Studie) | ||
| 1 | Boehringer Ingelheim: Fachinformation PRADAXA, Stand März 2008 | |
| 2 | GROSS, P.L., WEITZ, J.I.: Arterioscler. Thromb. Vasc. Biol. 2008; 28: 380-6 | |
| 3 | HIRSH, J. et al.: Circulation 2007; 116: 552-60 | |
| 4 | EMEA: Europ. Beurteilungsbericht (EPAR) PRADAXA, Stand April 2008 zu finden unter: http://www.emea.europa.eu/htms/human/epar/p.htm | |
| 5 | IEKO, M.: Curr. Opin. Investig. Drugs 2007; 8: 758-68 | |
| R | 6 | ERIKSSON, B.I. et al.: J. Thromb. Haemost. 2005; 3: 1003-11 |
| R | 7 | ERIKSSON, B.I. et al.: J. Thromb. Haemost. 2007; 5: 2178-85 |
| R | 8 | ERIKSSON, B.I. et al.: Lancet 2007; 370: 949-56 |
| 9 | FRIEDMAN, R.J. et al.: J. Thromb. Haemost. 2007; 5 (Suppl. 1; Abstract) | |
| 10 | GEERTS, W.H. et al.: Chest 2004; 126: 338S-400S | |
| 11 | KAUL, S., DIAMOND, G.A.: Ann. Intern. Med. 2006; 145: 62-9 | |
| 12 | NORRIE, J.: Lancet 2007; 370: 915-7 | |
| 13 | Guideline on Clinical Investigation of Medicinal Products for Prophylaxis of High Intra- and Post-Operative Venous Thromboembolic Risk
http://www.emea.europa.eu/pdfs/human/ewp/70798en_fin.pdf | |
| * | Ecarinzeit = Gerinnungstest, vor allem zur Kontrolle einer Hirudintherapie. | |
| ** | Für die Studienakronyme finden wir keine Erklärungen. |
© 2008 arznei-telegramm, publiziert am 9. Mai 2008
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
