ZWEITER HPV-IMPFSTOFF CERVARIX
Seit Oktober bietet GlaxoSmithKline (GSK) mit CERVARIX den zweiten Impfstoff gegen humane Papillomviren (HPV) zur Vorbeugung von höhergradigen intraepithelialen Neoplasien (CIN* 2 und 3) und Karzinomen des Gebärmutterhalses an, soweit diese durch die HPV-Typen 16 und 18 verursacht werden.1 Im Gegensatz zu der seit einem Jahr verfügbaren HPV-Vakzine GARDASIL (a-t 2007; 38: 57-9; 2006; 37: 117-9) enthält CERVARIX nur Eiweißstrukturen der beiden onkogenen HPV-Typen 16 und 18. Es schützt daher nicht vor Genitalwarzen (Condylomata acuminata), die überwiegend durch die in GARDASIL zusätzlich enthaltenen Niedrigrisiko-Typen 6 und 11 hervorgerufen werden. CERVARIX ist für Mädchen und junge Frauen zwischen 10 und 25 Jahren zugelassen. In den USA hat der Hersteller einen Antrag auf Zulassung erst im März gestellt, mit einer Entscheidung ist frühestens Anfang 2008 zu rechnen.2
| * | CIN 1 = geringgradige (leichte) Dysplasie CIN 2 = mäßiggradige (mittelschwere) Dysplasie CIN 3 = hochgradige (schwere) Dysplasie oder Carcinoma in situ |
Mit einem monatlichen Umsatz von 25 Mio. € (Herstellerabgabepreis) ist GARDASIL seit Monaten umsatzstärkstes Arzneimittel in Deutschland.3 GSK sieht die Vorteile von CERVARIX ("verstärkte Immunantwort"4) in höheren Antikörpertitern und einer langanhaltenden Immunantwort aufgrund eines neuartigen Adjuvans.5 Die Firma hat im Januar 2007 eine direkte Vergleichsstudie begonnen, in der primär die Immunogenität beider Impfstoffe geprüft werden soll.2
EIGENSCHAFTEN: Wie GARDASIL basiert die Immunogenität von CERVARIX auf virusähnlichen Partikeln des Hauptkapsidproteins des HP-Virus, die keine virale DNA enthalten und daher nicht infektiös sind. Diese werden bei GARDASIL von Hefezellen produziert, bei CERVARIX von Insektenzellen. Die Vakzine ist der erste zur Anwendung beim Menschen bestimmte Impfstoff, bei dem das so genannte Baculovirus-Expression-Vektor-System** Verwendung findet.6 Außerdem enthält sie als Adjuvans Monophosphoryl Lipid A, ein gereinigtes bakterielles Lipid, das die Immunreaktion verstärken soll und zur weiteren Erhöhung der Immunogenität mit den Eiweißpartikeln an eine Aluminiumverbindung adsorbiert (gebunden) ist.6
Für die Grundimmunisierung werden jeweils 0,5 ml an Tag 1 und nach einem (GARDASIL nach zwei) sowie nach sechs Monaten intramuskulär injiziert. Daten zur gleichzeitigen Anwendung mit anderen Impfstoffen liegen nicht vor.1
| ** | Baculoviren sind auf bestimmte Insekten spezialisiert. Sie werden seit den 1940er Jahren als Biopestizide in Getreidefeldern eingesetzt, um Schadinsekten zu dezimieren, und seit den 1990er Jahren zur Produktion von Eukaryonten-Proteinen. Dazu wird ihnen ein Gen eingeschleust, das sie zur Produktion der gewünschten Eiweiße befähigt. |
IMMUNOGENITÄT: Ein minimal schützender Antikörper-Titer ist für HPV-Impfstoffe nach wie vor nicht bekannt.6 Nach Daten aus einer Zwischenanalyse der Extensionsphase einer Studie, an der nur 70% der ursprünglich randomisierten Frauen teilnehmen, lassen sich durchschnittlich 54 Monate nach Grundimmunisierung mit CERVARIX bei mehr als 98% Antikörper gegen HPV 16 und 18 nachweisen. Die mittleren Titer liegen ein Mehrfaches über den Spiegeln nach natürlich erworbener Infektion.6 Die Aussagekraft dieser in einer Subgruppe gemessenen Ergebnisse ist begrenzt. Ob CERVARIX hier GARDASIL überlegen ist, bei dem nach 30 Monaten nur noch 76% der Geimpften Antikörper gegen HPV 18 aufweisen,7 bleibt daher offen. 10- bis 14-Jährige entwickeln nach dreimaliger Immunisierung mit CERVARIX mindestens doppelt so hohe mittlere Antikörpertiter wie 15- bis 25-jährige Frauen. Die klinische Relevanz lokaler Antikörper im Zervix- und Vaginalsekret ist unklar.6
VORSICHT DESINFORMATION: SANOFI PASTEUR MSD ÜBER DIE BEDROHUNG DURCH DAS ZERVIXKARZINOM
"Liebe Mutter, dies zu wissen, kann das Leben Ihrer Tochter retten!" Mit Plakaten in Apotheken, Handzetteln, in Rundfunk und Fernsehen und im Internet macht der GARDASIL-Hersteller Sanofi Pasteur MSD seit Monaten auf die "ernsthafte Bedrohung Ihrer Gesundheit" durch Gebärmutterhalskrebs aufmerksam: Gebärmutterhalskrebs könne jede Frau treffen, es sei die zweithäufigste krebsbedingte Todesursache bei Frauen zwischen 15 und 44 Jahren, ausgelöst durch das humane Papillomvirus, das weit verbreitet sei und sehr leicht übertragen werden könne.1,2 Die Aussagen erfüllen offenbar ihren Zweck: Die Vakzine erhielt jetzt den PZ-Innovationspreis 2007 der Pharmazeutischen Zeitung, "weil damit erstmals eine Prävention eines bei jungen Frauen häufig auftretenden Krebses möglich sei".3
Die Aussagen der Firma sind nicht allesamt falsch, vermitteln aber einen falschen Eindruck: Das Zervixkarzinom ist bei Frauen der zweithäufigste Krebs weltweit, wobei 80% der Erkrankungen in Entwicklungsländern auftreten. Hierzulande nimmt Gebärmutterhalskrebs Rang 10 der bösartigen Neubildungen der Frau ein. Bei den Krebssterbefällen lag es 2002 bei Frauen an zwölfter Stelle.4 2006 sind in Deutschland insgesamt 7.801 15- bis 45-jährige Frauen verstorben, davon 184 (2,4%) an einem Zervixkarzinom (Rang 9 der 10 häufigsten Todesursachen dieser Altersgruppe). Berücksichtigt man, dass die Sterberate in diesem Alter glücklicherweise mit 0,05% sehr niedrig ist, so beträgt sie für Gebärmutterhalskrebs entsprechend 0,001% (1 :100.000).5
| 1 | Sanofi Pasteur MSD: Plakat der Aktion "tell someone", undatiert | |
| 2 | Sanofi Pasteur MSD: Broschüre der Aktion "tell someone", undatiert | |
| 3 | GENSTHALER, B.M.: Pharm. Ztg. 2007; 152: 3690 | |
| 4 | Gesellschaft d. epidemiol. Krebsregister in Deutschland e.V., Robert Koch-Institut: Krebs in Deutschland, Stand 2006 | |
| 5 | Statistisches Bundesamt: Mitteilung vom 26. Okt. 2007 |
KLINISCHE WIRKSAMKEIT: Der Nutzennachweis von CERVARIX basiert im Wesentlichen auf der multizentrischen doppelblinden PATRICIA***-Studie, in der die HPV-Vakzine bei mehr als 18.000 15- bis 25-jährigen Frauen mit einem Hepatitis-A-Impfstoff (HAVRIX u.a.; in der Erprobung befindliche Formulierung) als Kontrolle verglichen wird. Die Frauen sind im Mittel 20 Jahre alt und dürfen zuvor bis zu sechs verschiedene Sexualpartner gehabt haben. Bei jeder Fünften lässt sich eingangs im Zervixabstrich DNA verschiedener onkogener HPV-Typen nachweisen. Die Zulassung beruht ebenso wie eine Publikation der Studie8 auf einer Zwischenanalyse nach einer mittleren Nachbeobachtungszeit von 15 Monaten ab der ersten Impfung. Wie bei GARDASIL werden für den primären Endpunkt (Rate mindestens höhergradiger Zervixdysplasien [CIN 2+], in denen HPV 16 und/oder 18 nachgewiesen werden) nur Frauen ausgewertet, die eingangs keine (frühere) Infektion mit dem entsprechenden HPV-Typ aufweisen. Dabei ergibt sich für CERVARIX eine Effektivität von 90,4% (2/7.788 versus 21/7.838 in der Kontrollgruppe; 97,9% Konfidenzintervall [CI] 53,4-99,3).8 In einer nachträglich geplanten Analyse, in die nur Läsionen eingehen, die aufgrund des vorherigen Nachweises des entsprechenden HPV-Typs in Zervixabstrichen als "wahrscheinlich kausal mit HPV 16 und/oder 18 assoziiert" eingestuft werden, beträgt der Schutz 100% (0 vs. 20 Dysplasien; 97,9% CI 74,2-100).6 Für HPV 18 allein lässt sich, vermutlich aufgrund der noch kleineren Fallzahlen, in beiden Analysen kein statistisch signifikanter Effekt belegen.8
| *** | PATRICIA = Papilloma trial against cancer in young adults |
Sekundär werden unter anderem die Raten von über sechs bzw. zwölf Monate persistierenden Infektionen mit HPV 16, 18 sowie zwölf weiteren onkogenen HPV-Typen untersucht. Da diese eine hohe Rückbildungstendenz haben, lassen sich daraus - wie auch aus dem in einer weiteren Studie primär geprüften Endpunkt "Neuinfektionen"9,10 - keine sicheren Rückschlüsse auf einen klinischen Nutzen hinsichtlich der Verhinderung von Zervixdysplasien oder -karzinomen ziehen. Die europäische Arzneimittelbehörde sieht derzeit keine hinreichende Evidenz dafür, dass CERVARIX einen Schutz vor anderen onkogenen HPV-Typen ("cross-protection") bietet.6
OFFENE FRAGEN: Ebenso wie bei GARDASIL werden entscheidende Daten zur Beurteilung des Nutzens von CERVARIX nicht mitgeteilt: Wie häufig kommen in der ausgewerteten Population, die die Zielgruppe einer HPV-Impfung repräsentieren soll, nämlich junge, noch gar nicht infizierte Frauen, höhergradige Dysplasien mit anderen als den im Impfstoff enthaltenen onkogenen HPV-Typen 16 und 18 vor und wie hoch ist bei ihnen die Rate solcher Läsionen insgesamt (alle HPV-Typen)? Für CERVARIX liegt darüber hinaus nicht einmal eine echte Intention-to-Treat-Analyse vor, in der alle Teilnehmerinnen ausgewertet werden, unabhängig davon, ob sie zu Studienbeginn mit einem der Impfstoff-HPV-Typen infiziert waren oder nicht.
Bei beiden HPV-Impfstoffen bleibt offen, ob langfristig andere onkogene HPV-Typen die Lücke füllen könnten, die durch einen Wegfall von HPV 16 und 18 entsteht (Replacement). Wie bei Windpocken könnten HPV-Infektionen zudem schwerer verlaufen, wenn sie nach Abklingen des Impfschutzes erst im höheren Lebensalter auftreten.11 Die Rate persistierender Infektionen soll bei erwachsenen Frauen höher sein als bei jungen Mädchen.12 Ob der fehlende Schutz vor den Niedrigrisiko-Typen HPV 6 und 11 bei CERVARIX ausschließlich von Nachteil ist, ist derzeit ebenfalls völlig unklar: Es gibt Hinweise, dass Infektionen mit diesen Typen vor Krebs durch Hochrisiko-Typen schützen könnten.13
STÖRWIRKUNGEN: 91% klagen über Schmerzen an der Injektionsstelle, 16% sind dadurch in ihren Alltagsaktivitäten behindert. Bei 40% treten lokale Schwellung und/oder Rötung auf. Ebenfalls sehr häufig kommt es zu Müdigkeit (58%), Kopfschmerz (54%), Myalgie (52%), Arthralgie (21%) und gastrointestinalen Beschwerden (28%) sowie Fieber (12%), Hautausschlag und Urtikaria (je 10%).8 Die Inzidenz schwerwiegender unerwünschter Ereignisse (je 3,5%) und neu auftretender chronischer (1,5% vs. 1,7%) oder autoimmuner Erkrankungen (je 0,5%) ist unter CERVARIX und Hepatitis-A-Impfstoff etwa gleich.8
Schwangerschaften von Frauen, die 30 Tage vor bis 45 Tage nach der letzten Regel mit CERVARIX geimpft wurden, enden häufiger mit einem Spontanabort als nach Hepatitis-A-Impfung (11,0% vs. 5,7%). Laut europäischer Arzneimittelbehörde sind in der Literatur üblicherweise Raten zwischen 12% und 22% beschrieben.6 Insgesamt lassen sich mögliche Effekte der HPV-Vakzine auf Schwangerschaften derzeit schwer beurteilen, unter anderem weil in allen Studien ein sicherer Konzeptionsschutz vorgeschrieben war und die Zahl der Schwangerschaften daher gering ist.6
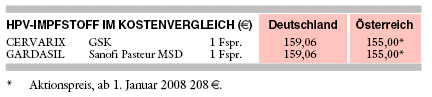
KOSTEN: CERVARIX wird mit 159,06 € pro Fertigspritze (477 €/Grundimmunisierung) exakt zum gleichen Preis angeboten wie GARDASIL. Mit einer 10er Packung (1.438,81 €) lassen sich bei beiden 10% einsparen.
Mit CERVARIX ist jetzt ein zweiter Impfstoff gegen humane Papillomviren (HPV) erhältlich, der im Gegensatz zu GARDASIL nur Bestandteile der beiden onkogenen HPV-Typen 16 und 18 enthält und zur Prävention von höhergradigen Zervixdysplasien und -karzinomen bei Mädchen und Frauen zwischen 10 und 25 Jahren zugelassen ist.
Die Zulassung basiert im Wesentlichen auf der Zwischenanalyse einer Studie mit einer mittleren Nachbeobachtungszeit von 15 Monaten nach der ersten Dosis. In diesem Zeitraum senkt die neue Vakzine die Rate höhergradiger Zervixdysplasien, in denen HPV 16 und/oder 18 nachgewiesen werden können, bei jungen Frauen, die zuvor nicht mit dem entsprechenden HPV-Typ infiziert waren, um 90%.
Daten zur Rate der Zervixdysplasien insgesamt, also unabhängig vom HPV-Typ, sowie für alle geimpften Frauen, unabhängig davon, ob sie zu Studienbeginn mit einem der beiden Impfstoff-HPV-Typen infiziert waren oder nicht, liegen für CERVARIX nicht vor. Die Datenlage ist daher noch unbefriedigender als für GARDASIL.
CERVARIX bietet keinen Schutz vor Genitalwarzen (Condylomata acuminata), da es die dafür überwiegend verantwortlichen HPV-Typen 6 und 11 nicht enthält. Ob dies ausschließlich von Nachteil ist, bleibt angesichts der unklaren Rolle, die diese Niedrigrisiko-HPV-Typen bei der Krebsentstehung spielen, offen.
Beide Impfstoffe werden exakt zum gleichen - unerhört hohen - Preis von
159,06 € pro Fertigspritze angeboten.
Aufgrund der Datenlage ist es derzeit unmöglich, den Nutzen der HPV-Impfung hinsichtlich der Prävention von Zervixkarzinomen sowie die Rolle anderer HPV-Typen abzuschätzen. Ob eine der beiden HPV-Vakzinen Vorteile hinsichtlich klinischen Nutzens, Immunogenität oder Verträglichkeit besitzt, lässt sich ebenfalls nicht beurteilen.
| (R = randomisierte Studie) | ||
| 1 | GSK: Fachinformation CERVARIX, Stand Sept. 2007 | |
| 2 | Scrip 2007; Nr. 3265: 24 | |
| 3 | Financial Times Deutschland vom 23. Aug. 2007 | |
| 4 | Ärzte Ztg. vom 22. Okt. 2007 | |
| 5 | Scrip 2007; Nr. 3279: 20 | |
| 6 | EMEA: Europ. Beurteilungsbericht (EPAR) CERVARIX, Stand Okt. 2007 zu finden unter: http://www.emea.europa.eu/htms/human/epar/c.htm | |
| R | 7 | VILLA, L.L. et al.: Vaccine 2006; 24: 5571-83 |
| R | 8 | PAAVONEN, J. et al.: Lancet 2007; 369: 2161-70 |
| R | 9 | HARPER, D.M. et al.: Lancet 2004; 364: 1757-65 |
| 10 | HARPER, D.M. et al.: Lancet 2006; 367: 1247-55 | |
| 11 | LIPPMAN, A. et al.: Can. Med. Ass. J. 2007; 177: 484-7 | |
| 12 | Ärzte Ztg. vom 25. Okt. 2007, S. 10 | |
| 13 | GARNETT, G.P., WADDELL, H.C.: J. Clin. Virol. 2000; 19: 101-11 |
© 2007 arznei-telegramm, publiziert am 9. November 2007
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
