THERAPIE DER ALTERSABHÄNGIGEN | ||||||
In a-t 2007; 38: 3-4 und 13-14 stellten wir Krankheitsbild und Diagnostik der altersabhängigen
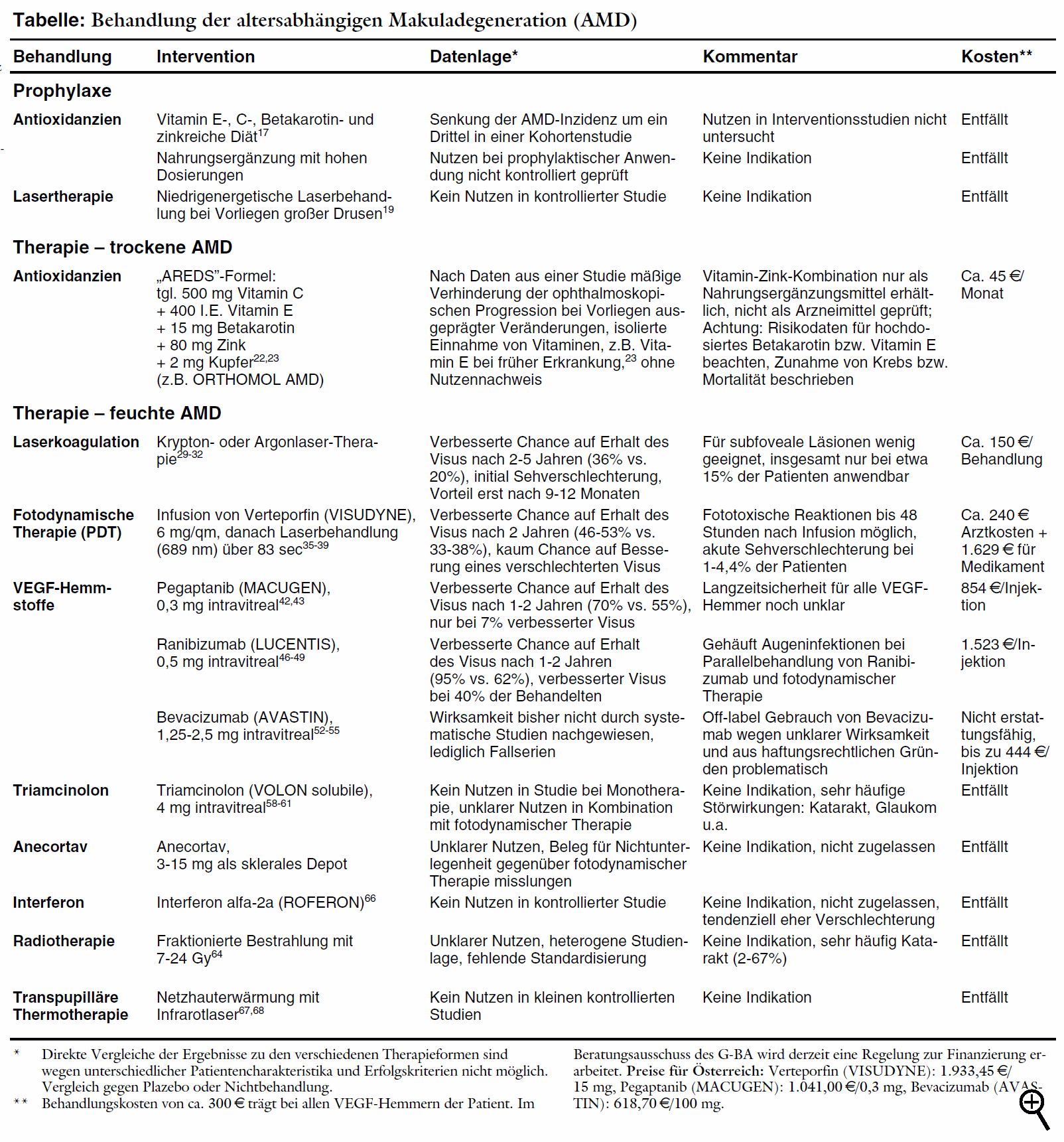
Makuladegeneration (AMD) sowie die Therapie der trockenen Verlaufsform dar. Im Folgenden beschreiben wir Therapiemöglichkeiten der feuchten
Verlaufsform. Der in den Studien gewählte Endpunkt Sehverschlechterung wird definiert als Verlust von mindestens 3 Zeilen (6 Zeilen bei Lasertherapie) auf der
EDTRS-Sehtafel. Weitere Definitionen und Erläuterungen siehe Kasten in a-t 2007; 38: 4.
Nach Daten aus einer Beobachtungsstudie lassen sich die Erfolge aus den mit Verteporfin durchgeführten Untersuchungen nur bei Beachtung der Einschlusskriterien und des Studienprotokolls reproduzieren. Abweichende Indikationsstellung und ungenügende Nachkontrollen zur Planung der weiteren Behandlung führen zu einem Verlauf, der dem unbehandelter Patienten entspricht.41 Nach einem Jahr wird unter 0,3 mg Pegaptanib bei 70% eine Visusverschlechterung verhindert gegenüber 55% unter Scheininjektion (NNT = 7). Weniger Patienten sind nach einem Jahr erblindet gemäß Studiendefinition (Visus unter 0,2: 38% vs. 56%). Eine relevante Visusverbesserung mit mehr als 15 Buchstaben Gewinn auf der Sehtafel erreichen jedoch nur wenig mehr Patienten unter Verum (6% vs. 2%). Die Wirksamkeit der drei Pegaptanibdosierungen ist vergleichbar. Störwirkungen sind vor allem durch die Injektion bedingt. Häufig kommt es zu Schmerzen (34% vs. 28%) und Glaskörpertrübungen (33% vs. 8%) sowie Entzündungen der vorderen Augenkammer (14% vs. 6%). Endophthalmitis tritt bei 1,3% der Patienten auf. Verletzung der Linse ist bei 0,6%, Ablösung der Retina bei 0,7% der Patienten beschrieben. Die notwendige Dauer der Behandlung ist unklar. Absetzen nach einem Jahr führt im Vergleich zur Behandlung über weitere zwölf Monate zu erneuter Progression.43 Für den bereits seit Längerem in der Schweiz44 und den USA erhältlichen monoklonalen VEGF-Antikörper Ähnlich sind die Ergebnisse beim direkten Vergleich mit fotodynamischer Therapie bei klassischen Läsionen.47 423 Patienten werden mit Ranibizumab (0,3 mg oder 0,5 mg) oder mit Verteporfin als Fotosensitizer behandelt. Der Visus bleibt bei 96% unter Ranibizumab gegenüber 64% unter Verteporfin erhalten (NNT = 3). Eine Visusverbesserung erreichen 40% unter 0,5 mg Ranibizumab vs. 6% unter Verteporfin. Bei Verlängerung der Injektionsabstände auf drei Monate nimmt nach Daten aus einer dritten Studie möglicherweise die Wirksamkeit ab. Nach anfänglich verbesserter Sehschärfe unter monatlichen Behandlungen verschlechtert sich diese bei Fortführung der Therapie mit größeren Dosierungsintervallen wieder.48,49 Schwere Störwirkungen sind injektionsbedingte Entzündungen des Auges (Endophthalmitis, ca. 1%) und Uveitis (0,7%). In einem Brief an amerikanische Augenärzte warnt der Hersteller aufgrund von Daten aus einer noch laufenden Sicherheitsstudie mit 5.000 Patienten jetzt vor einem erhöhten Schlaganfallrisiko unter der zugelassenen Dosis von 0,5 mg Ranibizumab (1,2% vs. 0,3% unter 0,3 mg; p = 0,02).70 Ein weiteres Risikosignal für nichtokuläre Störwirkungen ist die erhöhte Blutungsrate sowohl im Vergleich zu Scheininjektion (8,8% vs. 5,5%) als auch gegenüber Verteporfin (6,4% vs. 2,1%).46,47 In der 0,5 mg-Gruppe entwickeln nach zwei Jahren 6,3% der Patienten Antikörper gegen Ranibizumab, deren Bedeutung unklar ist. Nach Subgruppenauswertungen besteht kein sicherer Zusammenhang zwischen Antikörperentwicklung und Therapieerfolg oder Störwirkungen. Allerdings erkranken einige Patienten mit hohen Antikörpertitern an Augenentzündungen.48 Die kombinierte Behandlung von Ranibizumab mit fotodynamischer Therapie erscheint problematisch: In einer kontrollierten Studie mit 162 Patienten bleibt der Visus unter der Kombination zwar häufiger erhalten als bei alleiniger fotodynamischer Behandlung (90,5% versus 67,9%). Die Kombination führt jedoch unerwartet häufig zu Augenentzündungen (11,4%) und Verdacht auf Endophthalmitis (4,8%). Ob die Verlängerung der Abstände zwischen fotodynamischer Therapie und Injektion von Ranibizumab das Entzündungsrisiko senkt, konnte trotz Umstellung des Protokolls in der laufenden Studie nicht ermittelt werden.50 Unklar ist die Langzeitsicherheit aller VEGF-Hemmstoffe: Die blockierten Wachstumsfaktoren besitzen neben Einflüssen auf Gefäßwachstum und -durchlässigkeit zusätzliche neuroprotektive Eigenschaften. Eine dauerhafte Blockade kann nach tierexperimentellen Daten zur Entwicklung einer retinalen Atrophie beitragen.51 Die Einführung von Ranibizumab in Deutschland hat für die Versichertengemeinschaft möglicherweise schwere finanzielle Konsequenzen. Eine Injektionsflasche wird 1.523 € kosten. Bei monatlicher Anwendung bedeutet dies pro Patient und Jahr Kosten von rund 18.276 €. Für die Patienten ist von Relevanz, dass sie derzeit generell die Kosten für die intravitreale Injektion zu tragen haben (300 € pro Eingriff), da eine entsprechende Abrechnungsziffer auch bei Anwendung zugelassener Arzneimittel fehlt. Haftungsrechtlich ist die Off-label-Anwendung im Rahmen dieser "individuellen Heilversuche" problematisch. Die Patienten müssen unbedingt besonders umfassend über alle möglichen, auch seltenen Risiken aufgeklärt werden. Dabei wird in der Rechtsprechung ein deutlich strengeres Maß als bei zugelassenen länger bekannten Arzneimitteln angelegt: Aufgrund des geringen Kenntnisstandes müssen Patienten auch über die Möglichkeit bislang unbekannter, unerwarteter Störwirkungen informiert werden.56 Eine Vergleichsstudie mit Bevacizumab und Ranibizumab ist von den US-amerikanischen National Institutes of Health geplant, da der Hersteller Genentech, der die Lizenz für beide Wirkstoffe hält, kein Interesse an einer systematischen Überprüfung hat.57 Der nach unkontrollierten Daten59 vermutete Nutzen einer Monotherapie mit Kortikoiden auf den Verlauf einer altersabhängigen Makuladegeneration wird in einer randomisierten kontrollierten Studie mit 151 Patienten nicht bestätigt.60,61 Ein Jahr nach einmaliger intravitrealer Injektion von 4 mg Triamcinolon oder Plazebo kommt es in beiden Gruppen in gleichem Ausmaß zu einer Verschlechterung (Triamcinolon 26%, Plazebo 29%) auf der Sehtafel. Es häufen sich jedoch auch hier Katarakte unter dem Steroid: Bei 29% der mindestens ein Jahr nachbeobachteten Patienten unter Triamcinolon ist eine Katarakt-Operation notwendig, unter Plazebo nur bei 5%. Triamcinolon-Injektionen steigern den intraokkulären Druck und machen bei 28% der Behandelten eine drucksenkende Therapie erforderlich (1,3% unter Plazebo).61 Der Kortisolabkömmling Anecortav soll, subskleral als Depot injiziert, ausgeprägt antiangiogenetisch wirken, ohne typische Steroidnebenwirkungen oder antiinflammatorische Eigenschaften zu besitzen.62 Wegen unzureichender Nutzenbelege hat die europäische Arzneimittelbehörde ein negatives Votum angekündigt, der Zulassungsantrag für Anecortav wurde mittlerweile zurückgezogen.63 Radiotherapie soll ebenfalls Gefäßneubildungen verhindern. Die Autoren einer Cochrane-Übersicht halten nach Auswertung von elf kontrollierten Studien eine mäßige Verlangsamung der Sehverschlechterung zwar für möglich. Eine Bewertung ist jedoch aufgrund der Heterogenität und fehlenden Standardisierung nicht möglich.64 Hauptrisiko ist die Katarakt, die bei 2% bis 67% der Behandelten auftritt.65 Auch für Interferone wird eine antiangiogenetische Wirksamkeit angenommen. In einer randomisierten Studie war jedoch der Anteil der Patienten mit Verlust von mindestens drei Linien auf der Sehtafel unter drei unterschiedlichen Interferon alfa-2a (ROFERON)-Regimen nach einem Jahr numerisch höher als unter Plazebo (43% bis 54% vs. 38%).66 Bei der transpupillären Thermotherapie wird mit Hilfe eines niederenergetischen Infrarotlasers bei okkulter Gefäßneubildung eine Erwärmung der Netzhaut herbeigeführt, die die Gefäße verschließen soll. In kleinen randomisierten kontrollierten Studien mit lediglich 2567 bzw. 2868 Patienten lässt sich jedoch kein Vorteil gegenüber Scheinbehandlung feststellen. Eine 2005 auf einem Kongress vorgestellte kontrollierte Studie,69 nach der die Subgruppe der Patienten mit einem Visus unter 0,2 mit einer Visusverbesserung profitieren soll, ist bislang nicht veröffentlicht.
| ||||||
|
| (R = randomisierte Studie, M =
Metaanalyse) | |
2 | SINGERMAN, L.J. et al.: Retina 2005; 25 (7 Suppl.): S1-S22 | |
4 | FINE, S.L. et al.: N. Engl. J. Med. 2000; 342: 483-92 | |
17 | Van LEEUWEN, R. et al.: JAMA 2005; 294: 3101-7 | |
R | 19 | Complications of Age-Related Macular Degeneration Prevention Trial Research Group: |
R | 22 | Age-Related Eye Disease Study Research Group: Arch. Ophthalmol. 2001; 119: 1417-36 |
R | 23 | Age-Related Eye Disease Study Research Group: Control. Clin. Trials 1999; 20: 573-600 |
R | 29 | Macular Photocoag. Study Group: Arch. Ophthalmol. 1991; 109: 1109-14 |
R | 30 | Macular Photocoag. Study Group: Arch. Ophthalmol. 1994; 112: 500-9 |
R | 31 | Macular Photocoag. Study Group: Arch. Ophthalmol. 1993; 111: 1200-9 |
R | 32 | Macular Photocoag. Study Group: Arch. Ophthalmol. 1994; 112: 489-499 |
33 | Novartis Pharma: Fachinformation VISUDYNE, Stand Juli 2005 | |
34 | Gemeinsamer Bundesausschuss: | |
R | 35 | TAP Study Group: Arch. Ophthalmol. 1999; 117: 1329-45 |
R | 36 | TAP Study Group: Arch. Ophthalmol. 2001; 119: 198-207 |
R | 37 | VIM Study Group: Arch. Ophthalmol. 2005; 123: 448-57 |
R | 38 | VIP Study Group: Am. J. Ophthalmol. 2001; 131: 541-60 |
R | 39 | TAP Study Group: Arch. Ophthalmol. 2002; 120: 1307-14 |
40 | KAISER, P.K.: Graefe's Arch. Clin. Exp. Ophthalmol. 2006; 244: 1132-42 | |
41 | ESSEX, R.W. et al.: Clin. Experiment. Ophthalmol. 2003; 31: 476-81 | |
R | 42 | GRAGOUDAS. E.S. et al.: N. Engl. J. Med. 2004; 351: 2805-16 |
R | 43 | V.I.S.I.O.N Clinical Trial Group: Ophthalmology 2006; 113: 1508-21 |
44 | Novartis Pharma: http://www.novartis.ch/files/lucentis-20060829.pdf | |
45 | Novartis Pharma: Schreiben vom 25. Jan. 2007 | |
R | 46 | ROSENFELD, P.J. et al.: N. Engl. J. Med. 2006; 355: 1419-31 |
R | 47 | BROWN, D.M. et al.: N. Engl. J. Med. 2006; 355: 1432-44 |
48 | FDA: LUCENTIS, Approved Labeling;
| |
R | 49 | FDA:
LUCENTIS, Medical Review; |
R | 50 | HEIER, J.S. et al.: Arch. Ophthalmol. 2006; 124: 1532-42 |
51 | GILLIES, M.C.: Arch. Ophthalmol. 2006; 124: 1478-9 | |
52 | AVERY, R.L. et al.: Ophthalmology 2006; 113: 363-72 | |
53 | ITURRALDE, D. et al.: Retina 2006; 26: 279-84 | |
54 | SPAIDE, R.F. et al.: Retina 2006; 26: 383-90 | |
55 | BASHSHUR, Z.F. et al.: Am. J. Ophthalmol. 2006; 142: 1-9 | |
56 | Urteil des Bundesgerichtshofs vom 13.
Juni 2006; AZ VI ZR 323/04;
zu finden unter: | |
57 | National Eye Institute: Stellungnahme vom
Nov. 2006 | |
R | 58 | ARIAS, L. et al.: Ophthalmology 2006; 113: 2243-50 |
59 | PENFOLD, P.L. et al.: Aust. N. Z. J. Ophthalmol. 1995; 23: 293-8 | |
R | 60 | GILLIES, M.C. et al.: Arch. Ophthalmol. 2003; 121: 667-73 |
R | 61 | GILLIES, M.C. et al.: Arch. Ophthalmol. 2004; 122: 336-40 |
62 | BAKRI, S.J., KAISER, P.K.: Expert Opin. Investig. Drugs 2006; 15: 163-9 | |
63 | EMEA: Pressemitteilung vom 2. März
2006 | |
R | 64 | SIVAGNANAVEL, V. et al.: Radiotherapy for neovascular age-related macular degeneration; The Cochrane Database of Systematic Reviews 2007, Issue 1; Stand Mai 2004 |
65 | NICE: Radiotherapy for age-related
macular degeneration; März 2004 | |
R | 66 | Pharmacological Therapy for Macular Degeneration Study Group: Arch. Ophthalmol. 1997; 115: 865-72 |
R | 67 | MYINT, K. et al.: Acta Ophthalmol. Scand. 2006; 84: 328-32 |
R | 68 | GUSTAVSSON, C. et al.: Acta Ophthalmol. Scand. 2005; 83: 148-53 |
69 | GROVES, N.: Ophthalmology Times vom
1. Juni 2005; | |
70 | Genentech: Dear Healthcare Provider
Letter vom 24. Jan. 2007; |
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
