AROMATASEHEMMER BEI OPERABLEM | ||||||||||||||||||||||||||||||||||||||||||||||||||
Die adjuvante hormonelle Brustkrebstherapie mit Tamoxifen (NOLVADEX u.a.) senkt die Rezidivrate und wirkt lebensverlängernd. Die empfohlene
fünfjährige Einnahme ist einer kürzeren Anwendungsdauer überlegen.1 Mit Aromatasehemmern wie Anastrozol (ARIMIDEX) lässt
sich bei Frauen nach den Wechseljahren die Redizivrate nach operablem Hormonrezeptor-positivem Brustkrebs anscheinend weiter senken. Dies geht aus drei
Doppelblindstudien hervor, in denen die Mittel entweder alternativ (Anastrozol, ATAC*-Studie) oder im Anschluss an eine zwei- bis dreijährige (Exemestan
[AROMASIN], IES*-Studie) oder viereinhalb- bis sechsjährige (Letrozol [FEMARA], MA.*-17-Studie) Therapie mit Tamoxifen eingenommen werden (vgl. Tabelle
Seite 20).2-4 Alle drei Studien werden nach relativ kurzer Dauer von etwa zweieinhalb Jahren publiziert. Zur ATAC-Studie mit Anastrozol liegen inzwischen
Daten über 5,7 Jahre vor.5 Vor allem wegen der offenen Frage, ob die neuen Mittel die Sterblichkeit der Frauen beeinflussen, und wegen der
unbekannten Langzeittoxizität sahen wir vor einem Jahr in der adjuvanten Brustkrebstherapie mit Aromatasehemmern keinen neuen Therapiestandard (a-t 2005; 36: 2-3). Seither sind drei wesentliche Studienpublikationen hinzugekommen.
Ende 2005 ist eine weitere Untersuchung mit Letrozol erschienen (BIG** 1-98). Die vierarmige Doppelblindstudie prüft den Aromatasehemmer als fünfjährige endokrine adjuvante Therapie im Vergleich mit Tamoxifen sowie in zwei weiteren Gruppen den Wechsel von Tamoxifen hin zu Letrozol und umgekehrt, jeweils nach zweijähriger Initialbehandlung. 8.010 Frauen nach den Wechseljahren mit Hormonrezeptor-positivem Brustkrebs nehmen teil. Primärer Endpunkt ist wie in den bisherigen Studien das krankheitsfreie Überleben, definiert als Zeit bis zum Auftreten eines lokoregionalen oder distalen Rezidivs, eines Zweittumors in der kontralateralen Brust, eines Zweittumors an anderer Stelle oder Tod ohne vorherige Krebskomplikation. Für den jetzt publizierten Vergleich von Letrozol und Tamoxifen als initiale Option werden aus den Gruppen mit sequenzieller Therapie nur die Zeiten bis 30 Tage nach dem Wechsel ausgewertet.8
Bereits seit August 2005 liegt die gepoolte Auswertung von zwei Studien aus Österreich und Deutschland vor, in denen Frauen mit Hormonrezeptor-positivem Brustkrebs nach zweijähriger adjuvanter Tamoxifeneinnahme auf täglich 1 mg Anastrozol wechseln oder weiterhin Tamoxifen einnehmen. Auch diese Studien werden nach medianem Follow-up von 28 Monaten, gerechnet ab Abschluss der initialen hormonellen Therapie, vorzeitig publiziert. Im Unterschied zu den bisherigen Studien werden die beiden offen durchgeführt. Nicht einmal die Endpunkte werden verblindet erhoben.9 Ein weiteres schwerwiegendes methodisches Problem der gemeinsamen Auswertung besteht darin, dass die Frauen in der größeren der beiden Studien, dem österreichischen ABCSG***-trial-8, gleich nach der Operation randomisiert werden, also noch vor Beginn der zweijährigen Tamoxifeneinnahme. In der kleineren deutschen Studie (ARNO***95) wird die Randomisierung erst im Verlauf dieser zwei Jahre vorgenommen. Insgesamt werden 4.960 Frauen aufgenommen und randomisiert. Von der gemeinsamen Auswertung werden nun Patientinnen ausgeschlossen, die die zweijährige Initialbehandlung noch nicht beendet haben, während dieser Zeit die Therapie abgebrochen haben, gestorben sind oder Rezidive oder ein Zweitkarzinom entwickelt haben, sowie solche, die den Einschlusskriterien nicht entsprechen, insgesamt 1.736 Frauen oder 35%. Das Intention-to-treat-Prinzip wird somit eklatant verletzt. Die Verzerrungsmöglichkeiten aufgrund einer so hohen Ausschlussrate, noch dazu in offenen Studien, sind so groß, dass die Daten unseres Erachtens nicht verwertbar sind. Im Abstract der Publikation wird der Leser über den Sachverhalt getäuscht: Hier heißt es, dass die Frauen, die die zweijährige Tamoxifentherapie abgeschlossen hatten, randomisiert wurden, und genannt ist in diesem Zusammenhang nur die Zahl der ausgewerteten, nicht aber die Zahl der tatsächlich randomisierten Teilnehmerinnen.9

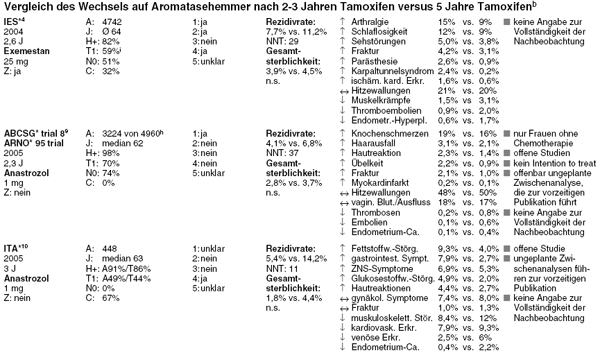

Nach spärlichen und inkonsistenten Angaben scheint auch bei den in die Auswertung aufgenommenen 3.224 Frauen die Nachbeobachtung
unvollständig zu sein. Auf der Basis dieser Daten errechnen die Autoren, dass sich durch Wechsel auf Anastrozol das Risiko eines lokoregionalen oder distalen
Rezidivs oder eines erneuten Karzinoms in der kontralateralen Brust im Verlauf von 28 Monaten auf 4,1% verringert im Vergleich zu 6,8% unter Fortführung von
Tamoxifen (HR 0,60; 95% CI 0,44-0,81). Mehr noch: Bei gepoolter Analyse dieser beiden Studien und einer dritten, italienischen Studie (ITA****)10
mit 448 Patientinnen soll sich durch Wechsel auf Anastrozol nach zwei- bis dreijähriger Tamoxifentherapie im Verlauf von 30 Monaten erstmals eine signifikante
Senkung der Gesamtsterblichkeit ergeben haben.11,12 Diese Metaanalyse wurde Ende vergangenen Jahres auf einem Kongress vorgestellt. Von den
ursprünglich randomisierten Frauen aus den österreichisch-deutschen Studien werden hier etwa 300 weitere mit ausgewertet.12 Es fehlen somit
aber immer noch rund 30%. Bei der italienischen Untersuchung handelt es sich ebenfalls um eine offene Studie ohne verblindete Endpunkterfassung, die auf der
Basis zweier ungeplanter Zwischenanalysen vorzeitig abgebrochen wird.10 Wie auch immer die bislang nicht vollständig veröffentlichte
Metaanalyse vorgenommen wurde, schon allein die Datenbasis erscheint für valide Aussagen völlig unzureichend.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| © 2006 arznei-telegramm |
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
