Der Hemmstoff der Monoaminoxidase B (MAO-B)  Rasagilin (AZILECT) ist seit
Juli zur Behandlung der idiopathischen PARKINSON-Krankheit und in Kombination mit Levodopa bei Patienten mit "End-of-dose-Fluktuationen" auf dem
Markt. Die Wirksamkeit des seit 1986 angebotenen ersten MAO-B-Hemmers Selegilin (MOVERGAN u.a.) in frühen Krankheitsphasen wird von den Autoren
einer systematischen Übersicht als gering und von fraglicher klinischer Relevanz eingestuft.1 Die Datenlage für späte Krankheitsstadien ist
unbefriedigend. Nach einer 1996 veröffentlichten britischen Studie steigt unter Selegilin in Kombination mit Levodopa die Sterblichkeit gegenüber alleiniger
Levodopa-Therapie (a-t 1996; Nr.1: 16). Rasagilin (AZILECT) ist seit
Juli zur Behandlung der idiopathischen PARKINSON-Krankheit und in Kombination mit Levodopa bei Patienten mit "End-of-dose-Fluktuationen" auf dem
Markt. Die Wirksamkeit des seit 1986 angebotenen ersten MAO-B-Hemmers Selegilin (MOVERGAN u.a.) in frühen Krankheitsphasen wird von den Autoren
einer systematischen Übersicht als gering und von fraglicher klinischer Relevanz eingestuft.1 Die Datenlage für späte Krankheitsstadien ist
unbefriedigend. Nach einer 1996 veröffentlichten britischen Studie steigt unter Selegilin in Kombination mit Levodopa die Sterblichkeit gegenüber alleiniger
Levodopa-Therapie (a-t 1996; Nr.1: 16).
EIGENSCHAFTEN: Der genaue Wirkmechanismus von Rasagilin ist nicht bekannt. Es hemmt die Aktivität von MAO-B irreversibel, in
geringerem Ausmaß auch von MAO-A, die beide für den Abbau von Dopamin im Gehirn verantwortlich sind. Dadurch soll die Dopamin-Konzentration im
zentralen Nervensystem ansteigen. Die geringere Affinität zu MAO-A soll Stör- und Wechselwirkungen reduzieren. Für die klinische Relevanz
angeblicher neuroprotektiver Eigenschaften von Rasagilin fehlen Belege.
Nach Einnahme per os wird Rasagilin zu einem großen Teil intestinal gebunden. Nur etwa ein Drittel der Dosis ist bioverfügbar. Der Wirkstoff wird in der
Leber durch Cytochrom P450 (CYP) 1A2 metabolisiert. Hemmstoffe von CYP 1A2 wie Gyrasehemmer und Fluvoxamin (FEVARIN) führen zu einer deutlich
erhöhten Serumkonzentration. Die gleichzeitige Einnahme von Pethidin (DOLANTIN), anderen MAO-Hemmern, Fluoxetin (FLUCTIN u.a.) oder Fluvoxamin ist
kontraindiziert. Diäteinschränkungen (Tyramin) sollen nicht erforderlich sein.
Die Eliminationshalbwertszeit beträgt dosisabhängig 0,3 bis 3,5 Stunden, die Wirkung hält jedoch aufgrund irreversibler Rezeptorbindung deutlich
länger an.2
WIRKSAMKEIT: Drei randomisierte kontrollierte Studien bilden die Grundlage der Zulassung.3-5 In einer 26-wöchigen Untersuchung
nehmen 404 Patienten mit milder bis mäßig fortgeschrittener PARKINSON-Erkrankung täglich 1 mg oder 2 mg Rasagilin bzw. Plazebo ein. Gemessen
wird die Veränderung auf einer Symptomskala mit 42 Items (Score-Bereich 0 bis 199). Gegenüber Plazebo kommt es zu einer Verbesserung des mittleren
Punktwertes um 4,2 (1 mg) und 3,6 (2 mg) bei Ausgangswerten von etwa 25.3 Dieser Unterschied ist zwar statistisch signifikant, jedoch von fraglicher
klinischer Relevanz und liegt in der Größenordnung der Wirkung von Selegilin.1 Die Zahl der Patienten, die zusätzlich Levodopa
benötigen, unterscheidet sich in den drei Gruppen nicht. Auch dies spricht gegen einen ausgeprägten klinischen Nutzen.
In zwei weiteren randomisierten kontrollierten Studien über 18 bzw. 26 Wochen wird der Einfluss auf "Off-Phasen" bei 687 und 472 Patienten im
fortgeschrittenen Krankheitsstadium überprüft.4,5 1 mg Rasagilin täglich reduziert die durchschnittliche "Off-Zeit" von 5,5 bis 6
Stunden pro Tag um etwa eine Stunde und damit ungefähr so viel wie der in einer der Studien als Kontrolle dienende COMT (Katechyl-O-Methyltransferase)-
Hemmer Entacapon (COMTESS).5 Zum Vergleich: In einer systematischen Übersicht wird für den Dopaminagonisten Pramipexol (SIFROL) eine
mittlere Reduktion der Off-Zeiten von 1,8 Stunden täglich errechnet.6
Direkte Vergleichsstudien von Rasagilin mit Selegilin liegen für beide Indikationen nicht vor.
SICHERHEIT: Versuche mit Mäusen lassen eine dosisabhängige Zunahme von Lungentumoren (Adenome und Adenokarzinome) erkennen. Die
europäische Zulassungsbehörde fordert daher weitere Studien.2
Während der klinischen Erprobung fällt eine Häufung maligner Melanome auf. Laut Produktinformation7 beträgt die Inzidenz von
Hautkarzinomen bei Monotherapie 1,3% versus 0,7% unter Plazebo, bei Kombination mit Levodopa liegt die Rate von Hautmelanomen bei 0,5% versus 0,3%. Eine
gesteigerte Melanominzidenz durch erhöhte Konzentrationen von Levodopa mit metabolischen Auswirkungen auf Melanozyten ist wiederholt diskutiert,
allerdings nie gesichert worden.8 Ob die erhöhte Rate daher durch substanzspezifische Toxizität ausgelöst, Ausdruck eines Klasseneffektes
oder zufällig zu Stande gekommen ist, bleibt zu klären.
Wie die Störwirkungen in den Zulassungsstudien erfasst worden sind, ist nicht beschrieben. In Kombination mit Levodopa kommt es im fortgeschrittenen
Krankheitsstadium gehäuft zu Dyskinesien (10,3% versus 6,4% unter Levodopa allein), Ataxie (1,3% vs. 0,3%) und Dystonien (2,4% vs. 0,8%).
Bewegungsstörungen werden unter Monotherapie nicht erwähnt. Hier kommen häufiger grippeähnliche Symptome (6,0% vs. 0,7% unter
Plazebo), Rhinitis (2,7% vs. 1,3%), Konjunktivitis (2,7% vs. 0,7%) u.a. vor.
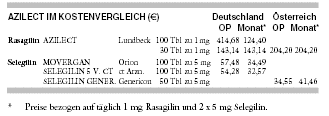
KOSTEN: Die Behandlung mit Rasagilin (AZILECT) ist mit 124 € monatlich nahezu viermal so teuer wie mit dem auch als Generikum verfügbaren
MAO-B-Hemmer Selegilin (SELEGILIN VON CT 33 €, MOVERGAN 34 €).
 Im Frühstadium der PARKINSON-Erkrankung verbessert der
Monoaminoxidase-B-Hemmer Im Frühstadium der PARKINSON-Erkrankung verbessert der
Monoaminoxidase-B-Hemmer  Rasagilin (AZILECT) die Motorik gering und von fraglicher
klinischer Relevanz. Der Effekt entspricht im indirekten Vergleich dem von Selegilin (MOVERGAN u.a.). Rasagilin (AZILECT) die Motorik gering und von fraglicher
klinischer Relevanz. Der Effekt entspricht im indirekten Vergleich dem von Selegilin (MOVERGAN u.a.).
 Als Zusatz zu Levodopa bei Patienten mit End-of-dose-Akinesie werden "Off-
Phasen" um etwa eine Stunde und somit im gleichen Ausmaß wie unter dem COMT-Hemmer Entacapon (COMTESS) reduziert. Dyskinesien nehmen unter
der Zusatztherapie zu. Als Zusatz zu Levodopa bei Patienten mit End-of-dose-Akinesie werden "Off-
Phasen" um etwa eine Stunde und somit im gleichen Ausmaß wie unter dem COMT-Hemmer Entacapon (COMTESS) reduziert. Dyskinesien nehmen unter
der Zusatztherapie zu.
 Beunruhigende Befunde sind Lungentumoren im Tierversuch (Maus) sowie
Melanome beim Menschen. Beunruhigende Befunde sind Lungentumoren im Tierversuch (Maus) sowie
Melanome beim Menschen.
 Eine Überlegenheit gegenüber dem deutlich preiswerteren Selegilin
(MOVERGAN u.a.) ist nicht belegt. Wir sehen keinen Stellenwert für die teure Pseudoinnovation. Eine Überlegenheit gegenüber dem deutlich preiswerteren Selegilin
(MOVERGAN u.a.) ist nicht belegt. Wir sehen keinen Stellenwert für die teure Pseudoinnovation.
|

